1 . 短周期元素可形成许多结构和性质不同的化合物,回答下列问题:

(1) 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为_____ (填化学式)。
(2) 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体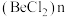 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为_____ 。
(3)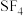 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断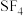 应采用结构
应采用结构_____ (填“a”或“b”)。
(4) 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了_____ (填化学式),比较它与 的稳定性并说明理由
的稳定性并说明理由_____ 。
(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成 立方体空隙如图,电子对
立方体空隙如图,电子对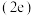 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对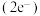 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了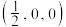 、
、 ,还有
,还有_____ ;若晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
_____  (用含
(用含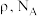 的代数式表示)。
的代数式表示)。


(1)
 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为(2)
 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体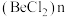 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为(3)
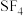 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断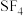 应采用结构
应采用结构(4)
 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了 的稳定性并说明理由
的稳定性并说明理由(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成
 立方体空隙如图,电子对
立方体空隙如图,电子对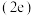 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对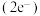 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了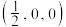 、
、 ,还有
,还有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
 (用含
(用含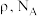 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
2 . 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1) 与
与 中更稳定的是
中更稳定的是______ (填化学式),原因为______ 。
(2)Ni与Co位于同一族,取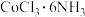 (黄色)、
(黄色)、 (紫红色)、
(紫红色)、 (绿色)和
(绿色)和 (紫色)四种化合物各1mol分别溶于水,分别加入足量的硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol。
(紫色)四种化合物各1mol分别溶于水,分别加入足量的硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol。
①根据实验事实用配合物的形式写出 的化学式:
的化学式:______ 。
②后两种物质的组成相同而颜色不同,写出其在水中的电离方程式:______ 。
(3)一种含Ni元素的化合物的晶胞Q的结构如图。
______ 。
②设Q的最简式的摩尔质量为Mg⋅mol ,
, 为阿伏加德罗常数的值,则该晶体的密度的计算式为
为阿伏加德罗常数的值,则该晶体的密度的计算式为______ g·cm 。
。
(4)一种由镍原子和镁原子共同构成,碳原子只填充在由镍原子构成的八面体空隙中的化合物,其晶胞结构如图所示。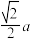 (其中a为晶胞参数)的Ni原子有
(其中a为晶胞参数)的Ni原子有______ 个。
②过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子的原子序数相同,称为有效原子序数规则。根据此规则,镍与CO形成的羰基配合物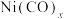 中,
中,
______ ,0.5mol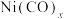 中含有
中含有______ molσ键。
(1)
 与
与 中更稳定的是
中更稳定的是(2)Ni与Co位于同一族,取
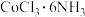 (黄色)、
(黄色)、 (紫红色)、
(紫红色)、 (绿色)和
(绿色)和 (紫色)四种化合物各1mol分别溶于水,分别加入足量的硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol。
(紫色)四种化合物各1mol分别溶于水,分别加入足量的硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol。①根据实验事实用配合物的形式写出
 的化学式:
的化学式:②后两种物质的组成相同而颜色不同,写出其在水中的电离方程式:
(3)一种含Ni元素的化合物的晶胞Q的结构如图。
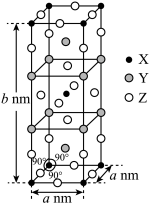

②设Q的最简式的摩尔质量为Mg⋅mol
 ,
, 为阿伏加德罗常数的值,则该晶体的密度的计算式为
为阿伏加德罗常数的值,则该晶体的密度的计算式为 。
。(4)一种由镍原子和镁原子共同构成,碳原子只填充在由镍原子构成的八面体空隙中的化合物,其晶胞结构如图所示。
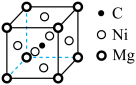
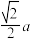 (其中a为晶胞参数)的Ni原子有
(其中a为晶胞参数)的Ni原子有②过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子的原子序数相同,称为有效原子序数规则。根据此规则,镍与CO形成的羰基配合物
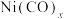 中,
中,
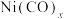 中含有
中含有
您最近半年使用:0次
2024-03-29更新
|
105次组卷
|
4卷引用:河北省保定市清苑中学等校2023-2024学年高二下学期3月月考化学试题
3 . 络合平衡遵循化学平衡移动原理。已知:①Ag++NH3 [Ag(NH3)]+ K1
[Ag(NH3)]+ K1
②[Ag(NH3)]++NH3 [Ag(NH3)2]2+ K2(K2>K1)。
[Ag(NH3)2]2+ K2(K2>K1)。
向饱和AgCl溶液中滴加氨水,lgX[X= 或
或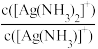 与lgc(NH3)关系如图所示:
与lgc(NH3)关系如图所示:
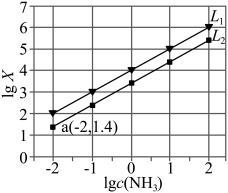
下列说法错误的是
 [Ag(NH3)]+ K1
[Ag(NH3)]+ K1②[Ag(NH3)]++NH3
 [Ag(NH3)2]2+ K2(K2>K1)。
[Ag(NH3)2]2+ K2(K2>K1)。向饱和AgCl溶液中滴加氨水,lgX[X=
 或
或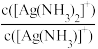 与lgc(NH3)关系如图所示:
与lgc(NH3)关系如图所示:
下列说法错误的是
| A.直线L2代表反应①中离子浓度关系 |
| B.络合平衡常数K2=1.0×104 |
| C.在上述混合液中加入足量盐酸,无明显现象 |
D.Ag++2NH3 [Ag(NH3)2]+的平衡常数K =107.4 [Ag(NH3)2]+的平衡常数K =107.4 |
您最近半年使用:0次
4 . 下列化合物是抗磁性的是
A. | B. | C. | D.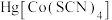 |
您最近半年使用:0次
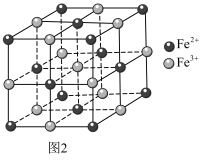
5 . 普鲁士蓝的化学式为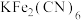 ,其结构如图1(可能位于中心的
,其结构如图1(可能位于中心的 未标出)或图2(
未标出)或图2( 、
、 未标出)所示。
未标出)所示。
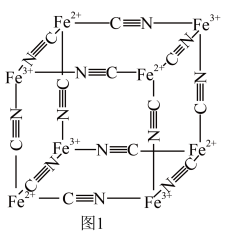
请回答:
(1)基态Fe价电子轨道表示式为_______ 。
(2)已知铁的电离能数据如下:
则,铁的第四电离能( )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:_______ 。
(3)关于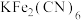 晶体下列说法不正确的是_______(填序号)。
晶体下列说法不正确的是_______(填序号)。
(4)可溶性氰化物(如KCN)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是_______ 。
(5)图2晶胞中 的个数为
的个数为_______ ,设普鲁士蓝的最简式的式量为Mr,晶体密度为 ,则相邻
,则相邻 之间的最短距离为
之间的最短距离为_______ nm。(列出计算式, 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 ,其结构如图1(可能位于中心的
,其结构如图1(可能位于中心的 未标出)或图2(
未标出)或图2( 、
、 未标出)所示。
未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为
(2)已知铁的电离能数据如下:
电离能/( ) ) |  |  |  |  | …… |
| Fe | 759 | 1561 | 2597 | 5290 | …… |
 )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:(3)关于
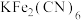 晶体下列说法不正确的是_______(填序号)。
晶体下列说法不正确的是_______(填序号)。| A.存在的化学键有σ键、π键、配位键、离子键等 |
B.Fe、N、C的电负性由大到小的顺序: |
C.晶体中 的键能>KCN中 的键能>KCN中 的键能 的键能 |
D.晶胞中 、 、 原子均参与形成配位键,其配位数之比为6:6 原子均参与形成配位键,其配位数之比为6:6 |
(5)图2晶胞中
 的个数为
的个数为 ,则相邻
,则相邻 之间的最短距离为
之间的最短距离为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近半年使用:0次
2023-05-06更新
|
684次组卷
|
4卷引用:浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题
浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题(已下线)【2023】【高三下】【模拟考】【温州三模】【高中化学】【李鼎收集】浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
6 . 固体化合物 由4种元素组成,某学习小组开展如图探究实验:
由4种元素组成,某学习小组开展如图探究实验:
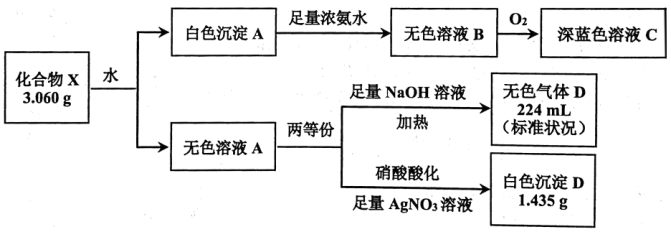
已知:白色沉淀 仅含两种元素。溶液
仅含两种元素。溶液 和溶液
和溶液 中阳离子由相同元素组成,且完全转化时,消耗标准状况下
中阳离子由相同元素组成,且完全转化时,消耗标准状况下 ,同时消耗
,同时消耗 。
。
请回答:
(1)无色气体 的电子式是
的电子式是_______ 。
(2)化合物 中的金属元素是
中的金属元素是_______ (填写元素符号),化学式是_______ 。
(3)写出无色溶液 转化为深蓝色溶液
转化为深蓝色溶液 的离子方程式
的离子方程式_______ 。
(4)白色沉淀 加水煮沸得到绿色溶液(溶质的元素组成与沉淀
加水煮沸得到绿色溶液(溶质的元素组成与沉淀 相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
①写出上述反应的化学方程式_______ 。
②设计实验方案证明红色固体是混合物_______ 。
 由4种元素组成,某学习小组开展如图探究实验:
由4种元素组成,某学习小组开展如图探究实验:
已知:白色沉淀
 仅含两种元素。溶液
仅含两种元素。溶液 和溶液
和溶液 中阳离子由相同元素组成,且完全转化时,消耗标准状况下
中阳离子由相同元素组成,且完全转化时,消耗标准状况下 ,同时消耗
,同时消耗 。
。请回答:
(1)无色气体
 的电子式是
的电子式是(2)化合物
 中的金属元素是
中的金属元素是(3)写出无色溶液
 转化为深蓝色溶液
转化为深蓝色溶液 的离子方程式
的离子方程式(4)白色沉淀
 加水煮沸得到绿色溶液(溶质的元素组成与沉淀
加水煮沸得到绿色溶液(溶质的元素组成与沉淀 相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。
相同),并转化为红色固体,该红色固体由一种单质和一种氧化物组成。①写出上述反应的化学方程式
②设计实验方案证明红色固体是混合物
您最近半年使用:0次
2021-09-02更新
|
896次组卷
|
2卷引用:浙江省“七彩阳光”2022届新高考研究联盟返校考试化学试题
7 . 绿色化学的核心是原子经济化学反应。采用高选择的配位催化过程是实现原子经济学反应的重要手段之一、如烯烃的氢甲酰化生产醛等工业的配位催化过程是绿色化学工业的代表。用RhCl( Pph3)3(A)作催化剂实现下面反应: (B) →
(B) →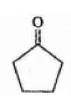 (G),其可能的机理如图:
(G),其可能的机理如图:
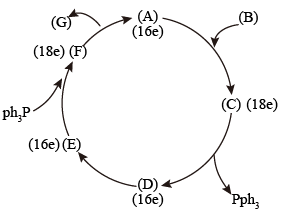
(C)中Rh的氧化态比(A)中Rh的氧化态大2
(1)试指出(A)、(C)、(D)、(E)、(F)中Rh的氧化态。___________
(2)试指出(A)、(C)、(D)、(E)、(F)中Rh原子的杂化类型。___________
(3)试画出与杂化类型相一致的(A)、(C)、(D)、(E)、(F)的结构式。___________
(4)指出(C)和(E)显颇磁性还是抗磁性,给出理由。___________
 (B) →
(B) → (G),其可能的机理如图:
(G),其可能的机理如图:
(C)中Rh的氧化态比(A)中Rh的氧化态大2
(1)试指出(A)、(C)、(D)、(E)、(F)中Rh的氧化态。
(2)试指出(A)、(C)、(D)、(E)、(F)中Rh原子的杂化类型。
(3)试画出与杂化类型相一致的(A)、(C)、(D)、(E)、(F)的结构式。
(4)指出(C)和(E)显颇磁性还是抗磁性,给出理由。
您最近半年使用:0次
8 . 金属M的三氯化物MCl3水溶液中加入锌汞齐后可得还原性溶液A,若将该溶液加入到醋酸钠的饱和溶液中可以得到难溶的红色晶体B。已知MCl3中Cl含量为67.16%,光谱分析表明,B分子呈中心对称,其中M原子的配位数为6(即M原子周围有6个原子与之成键),M原子含量27.64%,碳原子仅存在于醋酸根离子中,碳原子含量25.54%。试问:
(1)金属M的原子量为_______ 。
(2)红色晶体B中M原子和碳原子的个数比为_______ 。
(3)红色晶体B中和M原子配位的除了醋酸根离子还有_______ 。
(4)红色晶体B的分子式为_______ 。
(5)画出红色晶体B的结构图_______ 。
(1)金属M的原子量为
(2)红色晶体B中M原子和碳原子的个数比为
(3)红色晶体B中和M原子配位的除了醋酸根离子还有
(4)红色晶体B的分子式为
(5)画出红色晶体B的结构图
您最近半年使用:0次
9 . 羟基亚乙基二磷酸(HEDPA,结构式如下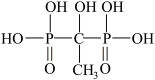 ,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
(1)根据元素分析数据,推证配合物A的分子式为____ 。
(2)画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)____ 。
(3)实验测得配合物A的磁矩为6.12μ0,配合物未成对电子数为___ ,中心原子的杂化轨道类型是____ 。
(4)如何将合成A的条件作修改,可得到多核配合物___ ,写出2种该多核配合物的分子式__ 。
(5)已知配合物[Mn(H2O)6]2+的d-d跃迁在400nm-550nm范围内有弱的吸收,配合物呈肉粉色,在水溶液中形成配合物后,中心离子的晶体场分裂能将发生怎样的变化____ 。观察配合物的颜色明显加深,为什么?___ 。
 ,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。(1)根据元素分析数据,推证配合物A的分子式为
(2)画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)
(3)实验测得配合物A的磁矩为6.12μ0,配合物未成对电子数为
(4)如何将合成A的条件作修改,可得到多核配合物
(5)已知配合物[Mn(H2O)6]2+的d-d跃迁在400nm-550nm范围内有弱的吸收,配合物呈肉粉色,在水溶液中形成配合物后,中心离子的晶体场分裂能将发生怎样的变化
您最近半年使用:0次
解题方法
10 . 钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。测定钢中钒含量的步骤如下:钢试样用硫磷混合酸分解,钒以四价形式存在。再用KMnO4将其氧化为五价,过量的KMnO4用NaNO2除去,过量的NaNO2用尿素除去。五价钒与N-苯甲酰-N-苯基羟胺在3.5 mol/L~5 mol/L盐酸介质中以1:2形成紫红色单核电中性配合物,比色测定。
回答如下问题:
(1)高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式_________ 。
(2)以反应方程式表示上述测定过程中KMnO4、NaNO2和尿素的作用_________ 。
(3)写出紫红色配合物的结构式_________ 。
回答如下问题:
(1)高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式
(2)以反应方程式表示上述测定过程中KMnO4、NaNO2和尿素的作用
(3)写出紫红色配合物的结构式
您最近半年使用:0次



