名校
1 . 下列说法不正确的是
| A.醋酸晶体的结构特征为分子密堆积,其配位数为12 |
| B.一束光通过氯化钠固体溶于酒精所形成的分散系,会产生丁达尔效应 |
| C.苯酚在60℃以上与水以任意比互溶,是因为破坏了苯酚分子间氢键,形成了苯酚与水分子间氢键 |
| D.在硫酸铜溶液中滴加氨水至过量,其实验过程可以证明与Cu2+结合能力:NH3>OH->H2O |
您最近一年使用:0次
2 . 葡萄糖的银镜反应实验如下:
步骤I:向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解。
步骤II:再向试管中加入1mL10%葡萄糖溶液,振荡,在60~70℃水浴中加热。
下列说法正确的是
步骤I:向试管中加入1mL2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解。
步骤II:再向试管中加入1mL10%葡萄糖溶液,振荡,在60~70℃水浴中加热。
下列说法正确的是
A.步骤I后的溶液中大量存在Ag+、 、OH-、 、OH-、 |
| B.银镜的产生证明葡萄糖分子中含羟基 |
| C.[Ag(NH3)2]+中Ag+提供空轨道、N原子提供孤电子对形成配位键 |
| D.可用氨水洗涤除去试管壁上残留的银 |
您最近一年使用:0次
2022-01-22更新
|
387次组卷
|
3卷引用:河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题
解题方法
3 . 碳(C)、氮(N)、氧(O)、硫(S)等是常见的非金属元素,钴(Co)是一种重要的金属元素,回答下列问题:
(1)一种由含钴的配合物形成的新型高能材料的结构如图所示。

①阴离子 是该材料的组成部分,则1mol该阴离子中含σ键的数目为
是该材料的组成部分,则1mol该阴离子中含σ键的数目为_______ (NA为阿伏加德罗常数的值),已知该离子是平面结构,则图中标记*的N和O原子之间的σ键是由N原子的_______ 杂化轨道与O原子的_______ 轨道重叠形成。
②写出一种与 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式)。
③实验证明NH3的极性比NCl3大,其原因是_______ 。
(2)一种新型环烯类储氢材料分子式为C16S8,分子中的原子都处于同平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。

①有关键长数据如下:
从表中数据可以推测C16S8中碳硫键的性质为_______ (填字母)。
A.类似于C-S单键的性质
B.类似于C=S双键的性质
C.兼有C-S单键和C=S双键的性质
②储氢时,C16S8与H2间的作用力是_______ 。
(3) 和NH3是配合物
和NH3是配合物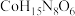 的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为
的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为_______ 。
(4)CoO2是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。

①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0),则C原子的坐标参数为_______ 。
②若阿伏加德罗常数的值为NA,则该晶体密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)一种由含钴的配合物形成的新型高能材料的结构如图所示。

①阴离子
 是该材料的组成部分,则1mol该阴离子中含σ键的数目为
是该材料的组成部分,则1mol该阴离子中含σ键的数目为②写出一种与
 互为等电子体的分子:
互为等电子体的分子:③实验证明NH3的极性比NCl3大,其原因是
(2)一种新型环烯类储氢材料分子式为C16S8,分子中的原子都处于同平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。

①有关键长数据如下:
| 化学键 | C-S | C=S | C16S8 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以推测C16S8中碳硫键的性质为
A.类似于C-S单键的性质
B.类似于C=S双键的性质
C.兼有C-S单键和C=S双键的性质
②储氢时,C16S8与H2间的作用力是
(3)
 和NH3是配合物
和NH3是配合物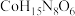 的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为
的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为(4)CoO2是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。

①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0),则C原子的坐标参数为
②若阿伏加德罗常数的值为NA,则该晶体密度为
 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
4 . 地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素。它们在化学中占有极其重要的地位。
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为___________
②金属钠原子的堆积方式是体心立方,其配位数为___________
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈___________ 色的物质是水合铜离子,请写出它的结构简式,并标明其中配位键___________
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式___________
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有___________ molσ键。
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:___________ (要求:仅写1个总的离子方程式)
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为
②金属钠原子的堆积方式是体心立方,其配位数为
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:
您最近一年使用:0次
名校
5 . 酞菁和酞菁钴可制得光动力学中的光敏剂,分子结构如图,其中酞菁分子中所有原子共平面。下列说法错误的是
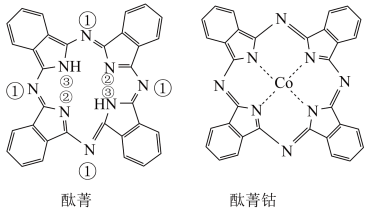
| A.酞菁中,标注③的N原子p轨道能提供1个电子 |
B.酞菁中,元素的第一电离能由大到小的顺序为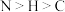 |
C.酞菁钴中,钻离子的化合价为 |
| D.酞菁钴中,钴离子的配位数为4 |
您最近一年使用:0次
名校
6 . 设 为阿伏加德罗常数的值,下列有关说法正确的是
为阿伏加德罗常数的值,下列有关说法正确的是
 为阿伏加德罗常数的值,下列有关说法正确的是
为阿伏加德罗常数的值,下列有关说法正确的是A.20g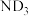 溶于水形成的氨水中质子数约为 溶于水形成的氨水中质子数约为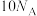 |
B.标准状况下,2.24L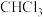 中含 中含 型 型 键数目为 键数目为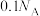 |
C. 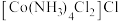 溶于水可电离出 溶于水可电离出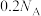 个 个 |
D.等物质的量的 和 和 所含有的电子数均为 所含有的电子数均为 |
您最近一年使用:0次
名校
7 . 硅铝酸盐沸石离子交换分子筛M-ZSM-5(M为Fe、Co、Ni、Cu)催化N2O氧化CH4制甲醇的反应机理如图所示,下列说法错误的是
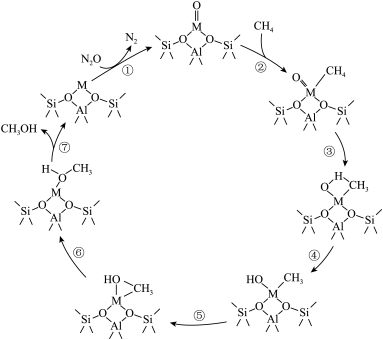
A.反应②的原子利用率为 |
B.反应①、②、③、⑥、⑦中, 的化合价发生了改变 的化合价发生了改变 |
C.M-ZSM-5能降低 氧化 氧化 制甲醇反应的活化能,改变反应的 制甲醇反应的活化能,改变反应的 |
D.总反应为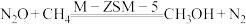 |
您最近一年使用:0次
2024-04-22更新
|
279次组卷
|
3卷引用:2024届河北省高三下学期部分学校4月质量检测化学试题
8 . 过渡元素钉(Ru)及其化合物用途广泛。利用水合肼( )还原
)还原 时获得了一种新的配合物
时获得了一种新的配合物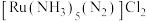 ,其配离子
,其配离子 结构如图。
结构如图。
 )还原
)还原 时获得了一种新的配合物
时获得了一种新的配合物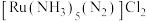 ,其配离子
,其配离子 结构如图。
结构如图。
A.在水合肼和 所含非金属元素中,电负性最大的元素为O 所含非金属元素中,电负性最大的元素为O |
B.当 形成配离子 形成配离子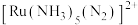 后, 后, 的键长将减小 的键长将减小 |
C.同周期且基态原子的单电子数与 相同的元素有2种 相同的元素有2种 |
D. 中心原子配位数为6 中心原子配位数为6 |
您最近一年使用:0次
解题方法
9 . 已知:硫代硫酸根( )可看作是
)可看作是 中的一个O原子被S原子取代的产物,
中的一个O原子被S原子取代的产物, 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成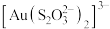 。下列有关说法正确的是
。下列有关说法正确的是
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物,
中的一个O原子被S原子取代的产物, 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成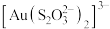 。下列有关说法正确的是
。下列有关说法正确的是A.SO3与 的键角相等 的键角相等 |
B. 与 与 的空间构型相同 的空间构型相同 |
| C. SO3是极性分子,故SO3易溶于水 |
D. 作为配体时,两种硫原子中只有端基硫原子能提供孤电子对 作为配体时,两种硫原子中只有端基硫原子能提供孤电子对 |
您最近一年使用:0次
名校
10 . 请回答下列问题:
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为___________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是___________ 。
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。___________ 。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),气态SiX4分子的空间结构是___________ 。___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键。
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。
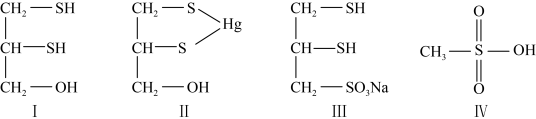
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N甲基咪唑(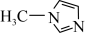 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
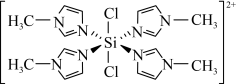
您最近一年使用:0次



