名校
解题方法
1 . 铁及其化合物在生产生活中应用非常广泛,回答下列问题:
(1)根据价电子排布规律,铁元素位于元素周期表的_______ 区,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.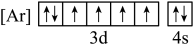 b.
b.
c.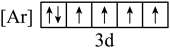 d.
d.
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝)。[Fe(CN)6]4-中σ键数目为_______ ,[Fe(CN)6]4-的空间结构为_______ 形。已知可溶性氰化物如KCN有剧毒,但普鲁士蓝无毒,请从结构角度解释原因:_______ 。
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为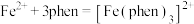 。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是
。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是_______ 。
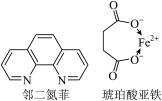
a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)Zn与S形成某种化合物的晶胞如图所示。
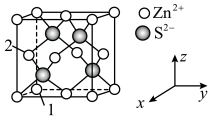
①用_______ 实验证明ZnS为晶体最科学。
②已知晶体密度为 ,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为_______ pm(写出计算表达式)。
(1)根据价电子排布规律,铁元素位于元素周期表的
a.
 b.
b.
c.
 d.
d.
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝)。[Fe(CN)6]4-中σ键数目为
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为
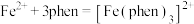 。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是
。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是
a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)Zn与S形成某种化合物的晶胞如图所示。

①用
②已知晶体密度为
 ,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
您最近一年使用:0次
2 . 某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验:
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。___________ ,仪器D的作用是___________ 。
(2)A中加浓盐酸,B中加 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。
①C中加淀粉碘化钾混合溶液,观察到C中溶液有___________ 的现象,即可证明;
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用___________ 溶液吸收尾气;
③ 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:___________ 。以镁为例,发现随着反应时间的进行,化学反应速率是先加快后减慢,分析先加快的主要原因可能是(假设不考虑固体质量的减少对反应速率的影响,填序号)___________ 。
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
请根据以上资料回答下列问题:
①根据资料猜测氯化铝是___________ (填“离子化合物”或“共价化合物”)。
②通过计算确定氯化铝含有配位键的结构式正确的是___________ 。___________ 。
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。

(2)A中加浓盐酸,B中加
 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。①C中加淀粉碘化钾混合溶液,观察到C中溶液有
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用
③
 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各
 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在
 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。请根据以上资料回答下列问题:
①根据资料猜测氯化铝是
②通过计算确定氯化铝含有配位键的结构式正确的是
A.  B.
B. C.
C.
您最近一年使用:0次
解题方法
3 . 离子液体是在室温附近温度下呈液体状态的盐类物质,一般由有机阳离子和无机阴离子组成。已知: 表示阿伏加德罗常数的值。下列关于离子液体
表示阿伏加德罗常数的值。下列关于离子液体 的说法错误的是
的说法错误的是
 表示阿伏加德罗常数的值。下列关于离子液体
表示阿伏加德罗常数的值。下列关于离子液体 的说法错误的是
的说法错误的是| A.该物质的熔沸点比氯化钠的高 |
B. 的空间构型为正四面体形 的空间构型为正四面体形 |
C. 中含有配位键的数目为 中含有配位键的数目为 |
D. 中 中 杂化的原子数目为 杂化的原子数目为 |
您最近一年使用:0次
解题方法
4 . 某些含氟有机化合物具有特异的生物活性和生物体适应性,疗效比一般药物强好几倍。实验室将 KF溶入18-冠-6(结构如图1)的乙腈(CH3CN)溶液中可轻松实现氟的取代,反应过程如图2所示:

A.用 与用18-冠-6络合钾离子的效率不同 与用18-冠-6络合钾离子的效率不同 |
| B.KF、18-冠-6 和乙腈均为极性分子,KF溶解度增大,与卤代烃充分接触 |
| C.C-O-C 键角:∠1大于乙醚中的 |
D.相同条件下,用 代替 代替  参与上述反应,反应速率会加快 参与上述反应,反应速率会加快 |
您最近一年使用:0次
5 . 血红蛋白结合 后的结构如图所示,
后的结构如图所示, 也可与血红蛋白结合。下列说法错误的是
也可与血红蛋白结合。下列说法错误的是
 后的结构如图所示,
后的结构如图所示, 也可与血红蛋白结合。下列说法错误的是
也可与血红蛋白结合。下列说法错误的是
A.血红蛋白中心离子 与卟啉环形成6个螯合键 与卟啉环形成6个螯合键 |
B. 与血红蛋白结合时, 与血红蛋白结合时, 原子提供孤电子对 原子提供孤电子对 |
C.第一电离能: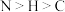 |
D.基态 含有4个未成对电子 含有4个未成对电子 |
您最近一年使用:0次
6 . 某同学对甲苯与高锰酸钾水溶液反应速率做了如下两个实验探究:
实验 .取一定量的甲苯与一定体积,一定浓度的高锰酸钾水溶液,混合,振荡10min,缓慢褪色。
.取一定量的甲苯与一定体积,一定浓度的高锰酸钾水溶液,混合,振荡10min,缓慢褪色。
实验 .在实验I的试剂取量基础上,再加入120g•L-1的冠醚(18-冠-6),振荡,4.5min褪色。
.在实验I的试剂取量基础上,再加入120g•L-1的冠醚(18-冠-6),振荡,4.5min褪色。
实验
 .取一定量的甲苯与一定体积,一定浓度的高锰酸钾水溶液,混合,振荡10min,缓慢褪色。
.取一定量的甲苯与一定体积,一定浓度的高锰酸钾水溶液,混合,振荡10min,缓慢褪色。实验
 .在实验I的试剂取量基础上,再加入120g•L-1的冠醚(18-冠-6),振荡,4.5min褪色。
.在实验I的试剂取量基础上,再加入120g•L-1的冠醚(18-冠-6),振荡,4.5min褪色。
| A.冠醚是该反应的催化剂 |
| B.18-冠-6合钾离子中所有非氢原子可以位于同一平面 |
| C.(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子,这种超分子可溶于甲苯 |
D.实验I反应速率小的原因是高锰酸钾不溶于甲苯,氧化剂MnO 与还原剂甲苯接触不充分 与还原剂甲苯接触不充分 |
您最近一年使用:0次
名校
解题方法
7 . 乙二胺四乙酸(简称EDTA,可用 表示)在化学分析中常用于配位滴定。水溶液中,EDTA常以
表示)在化学分析中常用于配位滴定。水溶液中,EDTA常以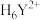 、
、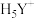 、
、 、
、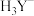 、
、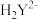 、
、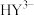 和
和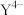 等7种形式存在。常温下,EDTA溶液中上述7种微粒的分布分数[如
等7种形式存在。常温下,EDTA溶液中上述7种微粒的分布分数[如 ]与溶液pH的关系如左图,图表示EDTA与某金属离子
]与溶液pH的关系如左图,图表示EDTA与某金属离子 形成的螯合物的结构。下列说法错误的是
形成的螯合物的结构。下列说法错误的是
 表示)在化学分析中常用于配位滴定。水溶液中,EDTA常以
表示)在化学分析中常用于配位滴定。水溶液中,EDTA常以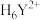 、
、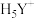 、
、 、
、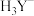 、
、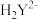 、
、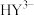 和
和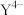 等7种形式存在。常温下,EDTA溶液中上述7种微粒的分布分数[如
等7种形式存在。常温下,EDTA溶液中上述7种微粒的分布分数[如 ]与溶液pH的关系如左图,图表示EDTA与某金属离子
]与溶液pH的关系如左图,图表示EDTA与某金属离子 形成的螯合物的结构。下列说法错误的是
形成的螯合物的结构。下列说法错误的是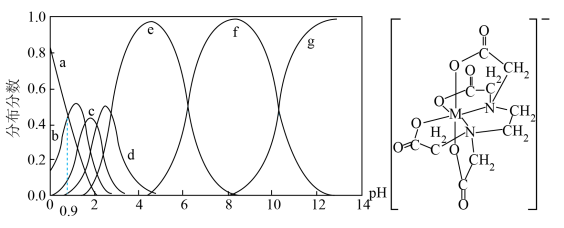
A.曲线d代表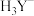 |
B. 时有 时有 |
| C.pH减小会降低EDTA与金属离子的配位能力 |
D. |
您最近一年使用:0次
2024-05-28更新
|
178次组卷
|
3卷引用:山东省滨州市2024届高三下学期二模化学试题
名校
解题方法
8 . 环戊二烯可用于制备二茂铁[Fe(C5H5)2],二茂铁(结构如图所示)是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法不正确的是
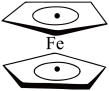

A.1 mol环戊二烯( )中含有11 mol σ键 )中含有11 mol σ键 |
| B.环戊二烯分子中所有原子共平面 |
| C.二茂铁中存在配位键 |
| D.Fe2+的价电子排布式为3d6 |
您最近一年使用:0次
9 . 含 的配合物呈现不同的颜色,在黄色
的配合物呈现不同的颜色,在黄色 溶液中,加入稀
溶液中,加入稀 ,至溶液接近无色,用该无色溶液做实验,现象如下:
,至溶液接近无色,用该无色溶液做实验,现象如下:
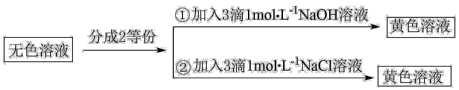
下列说法错误的是
 的配合物呈现不同的颜色,在黄色
的配合物呈现不同的颜色,在黄色 溶液中,加入稀
溶液中,加入稀 ,至溶液接近无色,用该无色溶液做实验,现象如下:
,至溶液接近无色,用该无色溶液做实验,现象如下: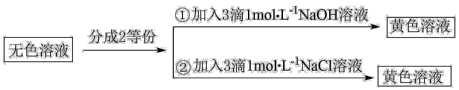
下列说法错误的是
A. 中 中 提供空轨道,O提供孤电子对 提供空轨道,O提供孤电子对 |
B. 溶液呈黄色是因为溶液中存在 溶液呈黄色是因为溶液中存在 |
C.实验②反应的离子方程式为: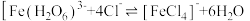 |
D.实验①现象说明 比 比 更易结合 更易结合 |
您最近一年使用:0次
名校
10 . 向盛有硫酸铜水溶液的试管里加入少量氨水,开始生成浅蓝色的碱式硫酸铜沉淀[Cu2(OH)2SO4],继续加入足量氨水时,沉淀溶解得到深蓝色的铜氨溶液,若在该溶液中加入乙醇,即得到深蓝色晶体[Cu(NH3)4]SO4•H2O。下列说法不正确的是
| A.在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子 |
| B.生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小 |
C.碱式硫酸铜与氨水反应的离子方程式:Cu2(OH)2SO4+8NH3•H2O=2[Cu(NH3)4]2++SO +2OH﹣+8H2O +2OH﹣+8H2O |
| D.深蓝色晶体中只含有离子键、配位键和氢键 |
您最近一年使用:0次
2024-03-30更新
|
91次组卷
|
2卷引用:山东省泰安市泰山国际学校2023-2024学年高二下学期3月月考化学试题



