名校
解题方法
1 . 某小组同学探究FeCl3溶液显黄色的原因。
资料:i.FeCl3溶液中存在平衡:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5]2++H3O+
ii.Fe3+与 不能形成配位键。
不能形成配位键。
(1)Fe3+的核外电子排布式为___________ 。
[猜想与预测]
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
Ⅰ.Fe3+与OH-配位 Ⅱ.Fe3+与H2O配位 Ⅲ.Fe3+与Cl-配位
(2)解释Fe3+可与这些微粒形成配合物的原因:___________ 。
[实验与分析]
为验证猜想I,小组同学设计并完成了以下实验。
(3)实验a的作用是___________ 。
(4)①甲同学认为实验c可以证明猜想Ⅰ成立,而猜想Ⅱ不成立,理由是___________ 。小组同学为了证明猜想Ⅲ成立,将实验c所得溶液分为两份进行了如下实验:
②实验d的实验现象为___________ ,证明猜想Ⅲ成立
[结论与反思]
(5)依据上述现象解释FeCl3溶液显黄色的原因是___________ 。
(6)已知EDTA与Fe3+配位能力比SCN-更强,设计实验证明Fe3+与EDTA形成的配合物为浅黄色(EDTA通常配成溶液使用):___________ 。
资料:i.FeCl3溶液中存在平衡:[Fe(H2O)6]3++H2O⇌[Fe(H2O)5]2++H3O+
ii.Fe3+与
 不能形成配位键。
不能形成配位键。(1)Fe3+的核外电子排布式为
[猜想与预测]
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
Ⅰ.Fe3+与OH-配位 Ⅱ.Fe3+与H2O配位 Ⅲ.Fe3+与Cl-配位
(2)解释Fe3+可与这些微粒形成配合物的原因:
[实验与分析]
为验证猜想I,小组同学设计并完成了以下实验。
| 实验 | a | b | c |
| 实验操作 | 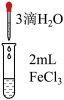 |  | 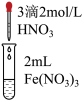 |
| 实验现象 | 溶液黄色略变浅 | 溶液黄色略变浅 | 黄色褪去 |
(4)①甲同学认为实验c可以证明猜想Ⅰ成立,而猜想Ⅱ不成立,理由是
| 实验 | d | e |
| 实验操作 | 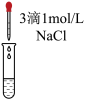 |  |
| 实验现象 | _______ | 溶液仍为无色 |
[结论与反思]
(5)依据上述现象解释FeCl3溶液显黄色的原因是
(6)已知EDTA与Fe3+配位能力比SCN-更强,设计实验证明Fe3+与EDTA形成的配合物为浅黄色(EDTA通常配成溶液使用):
您最近一年使用:0次
2 .  是原子序数依次增大的短周期元素,
是原子序数依次增大的短周期元素, 分别位于不同周期,
分别位于不同周期, 是同周期中金属性最强的元素。四种元素可“组合”成一种具有高效催化性能的超分子,其结构如图(
是同周期中金属性最强的元素。四种元素可“组合”成一种具有高效催化性能的超分子,其结构如图( 与
与 之间都是
之间都是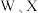 构成的相同结构)。下列说法错误的是
构成的相同结构)。下列说法错误的是
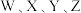 是原子序数依次增大的短周期元素,
是原子序数依次增大的短周期元素, 分别位于不同周期,
分别位于不同周期, 是同周期中金属性最强的元素。四种元素可“组合”成一种具有高效催化性能的超分子,其结构如图(
是同周期中金属性最强的元素。四种元素可“组合”成一种具有高效催化性能的超分子,其结构如图( 与
与 之间都是
之间都是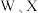 构成的相同结构)。下列说法错误的是
构成的相同结构)。下列说法错误的是
A. 位于第二周期第ⅥA族 位于第二周期第ⅥA族 | B. 单质不存在能导电的晶体 单质不存在能导电的晶体 |
C. 与 与 之间可能存在配位键 之间可能存在配位键 | D.利用该超分子可以分离简单 离子和钡离子 离子和钡离子 |
您最近一年使用:0次
名校
解题方法
3 . 普鲁士蓝的部分或全部铁离子可以被其他过渡金属离子取代形成类普鲁士蓝化合物,其具有独特的空心微纳米结构可以增大电极和电解质的接触面积,为电化学反应提供更多的活性位点,可应用于析氢、析氧反应,超级电容器和金属离子电池等。某种普鲁士蓝面心立方体结构如图所示,晶格常数为11.02nm。回答下列问题:
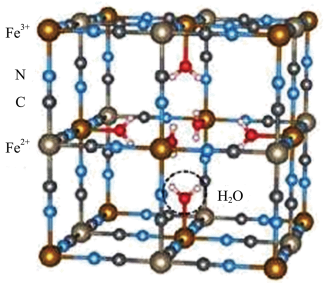
(1)写出Fe2+的核外电子排式为___________ 。
(2)写出一个与氰根离子(CN-)互为等电子体的分子的化学式___________ 。
(3)该晶体中与Fe3+形成配位键的配位原子有___________ (填元素名称);第一电离能最大的原子为___________ (填元素符号)。
(4)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为___________ 。
(5)该普鲁士蓝晶体密度为___________ g·cm-3(写出未经化简的表达式)。
(6)普鲁士蓝晶体中少部分铁原子被钴或镍原子取代可形成类普鲁士蓝,其晶体结构基本不变,但性能更加优良。下列有关替代原子说法错误的是
a.都处于副族,结构相似 b.常见化合价为+2或+3
c.均属于d区元素 d.替代离子与原离子的离子半径相近
(7)常用K3[Fe(CN)6]制备类普鲁士蓝化合物。在0.1mol·L-1 K3[Fe(CN)6]溶液中滴加几滴0.1mol·L-1 KSCN溶液,是否有血红色溶液生成,请通过计算说明。___________ (写出分析过程)
(已知:Fe3++6SCN-=Fe(SCN)
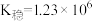 ;Fe3++6CN-=Fe(CN)
;Fe3++6CN-=Fe(CN)
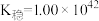 )。
)。

(1)写出Fe2+的核外电子排式为
(2)写出一个与氰根离子(CN-)互为等电子体的分子的化学式
(3)该晶体中与Fe3+形成配位键的配位原子有
(4)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为(5)该普鲁士蓝晶体密度为
(6)普鲁士蓝晶体中少部分铁原子被钴或镍原子取代可形成类普鲁士蓝,其晶体结构基本不变,但性能更加优良。下列有关替代原子说法错误的是
a.都处于副族,结构相似 b.常见化合价为+2或+3
c.均属于d区元素 d.替代离子与原离子的离子半径相近
(7)常用K3[Fe(CN)6]制备类普鲁士蓝化合物。在0.1mol·L-1 K3[Fe(CN)6]溶液中滴加几滴0.1mol·L-1 KSCN溶液,是否有血红色溶液生成,请通过计算说明。
(已知:Fe3++6SCN-=Fe(SCN)

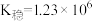 ;Fe3++6CN-=Fe(CN)
;Fe3++6CN-=Fe(CN)
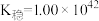 )。
)。
您最近一年使用:0次
名校
解题方法
4 . 生物大分子血红蛋白分子链的部分结构及载氧示意如图。下列说法错误的是
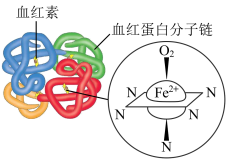

| A.构成血红蛋白分子链的多肽链之间存在氢键作用 |
B.血红素中 提供空轨道形成配位键 提供空轨道形成配位键 |
C. 与血红素中 与血红素中 配位能力强于 配位能力强于 |
| D.用酸性丙酮提取血红蛋白中血红素时仅发生物理变化 |
您最近一年使用:0次
2023-03-08更新
|
716次组卷
|
2卷引用:海南省海南中学2023届高三下学期第三次模拟考试化学试题
名校
解题方法
5 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第VIII族的元素,称为铁系元素,相关化合物在生产生活中应用广泛。
(1)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括____________ (填字母)。
A.极性键 B.非极性键 C.配位键 D.金属键 E.离子键
(2)镍能形成多种配合物,如 、
、 、
、 等,下列有关说法正确的是___________(填字母)。
等,下列有关说法正确的是___________(填字母)。
(3)Co3+的一种配离子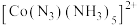 中,Co3+的配位数是
中,Co3+的配位数是_____________ ,Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是_____________ 。
(4)NiO晶胞与NaCl晶胞相似,如图所示_____________ 个;每个氧离子周围与它最近且相等距离的氧离子有_________ 个。
(1)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括
A.极性键 B.非极性键 C.配位键 D.金属键 E.离子键
(2)镍能形成多种配合物,如
 、
、 、
、 等,下列有关说法正确的是___________(填字母)。
等,下列有关说法正确的是___________(填字母)。A. 中含有 中含有 键的数目为 键的数目为 |
B. 中配体是CO,配位原子是C 中配体是CO,配位原子是C |
| C.NH3中N原子为sp3杂化,其空间构型为正四面体形 |
| D.Ni2+在形成配合物时其配位数只能为4,Fe在形成配合物时其配位数只能为5 |
(3)Co3+的一种配离子
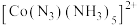 中,Co3+的配位数是
中,Co3+的配位数是(4)NiO晶胞与NaCl晶胞相似,如图所示
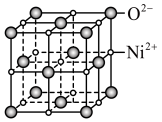
您最近一年使用:0次
2024-03-23更新
|
365次组卷
|
2卷引用:海南省琼海市嘉积中学2023-2024学年高二下学期月考化学试题
真题
名校
6 . 闭花耳草是海南传统药材,具有消炎功效。车叶草苷酸是其活性成分之一,结构简式如图所示。下列有关车叶草苷酸说法正确的是


| A.分子中含有平面环状结构 |
| B.分子中含有5个手性碳原子 |
| C.其钠盐在水中的溶解度小于在甲苯中的溶解度 |
| D.其在弱碱介质中可与某些过渡金属离子形成配合物 |
您最近一年使用:0次
2023-08-03更新
|
5798次组卷
|
7卷引用:2023年高考海南卷化学真题
2023年高考海南卷化学真题(已下线)不定项选择题江西省吉安市吉州区部分学校联考2022-2023学年高二下学期期末考试化学试题山东省淄博实验中学2023-2024学年高三上学期开学考试化学试题江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题(已下线)题型09 有机物的结构与性质-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
解题方法
7 . 材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的价层电子排布图为___________ ;基态As原子核外电子占据的能量最高的能级的电子云形状为___________ 。
(2)Si、P、S、Cl的第一电离能由大到小的顺序为___________ 。
(3)M与Ga位于同周期, 的一种配合物组成为
的一种配合物组成为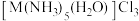 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是___________ (填字母)。
a.分子空间结构相同
b.中心原子杂化轨道类型相同
c.键角大小相同
②1mol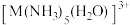 含
含___________ mol 键。
键。
③配合物T与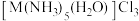 组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量 溶液可生成2mol
溶液可生成2mol 。则T的化学式为
。则T的化学式为___________ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,该晶胞中B原子与相邻的P原子构成___________ (填“立方体”“正四面体”或“正八面体”)。
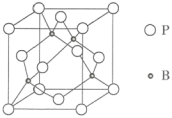
已知该晶体的密度为 ,设
,设 是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________ pm(列式即可)。
(1)基态Ge原子的价层电子排布图为
(2)Si、P、S、Cl的第一电离能由大到小的顺序为
(3)M与Ga位于同周期,
 的一种配合物组成为
的一种配合物组成为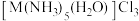 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间结构相同
b.中心原子杂化轨道类型相同
c.键角大小相同
②1mol
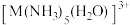 含
含 键。
键。③配合物T与
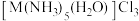 组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量 溶液可生成2mol
溶液可生成2mol 。则T的化学式为
。则T的化学式为(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,该晶胞中B原子与相邻的P原子构成

已知该晶体的密度为
 ,设
,设 是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
您最近一年使用:0次
解题方法
8 . 含硼物质在储氢、有机合成、超导等方面有广泛用途。
(1)金属催化剂M(Co、Ni)催化硼氢化钠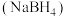 水解释放
水解释放 机理如下图所示:
机理如下图所示:
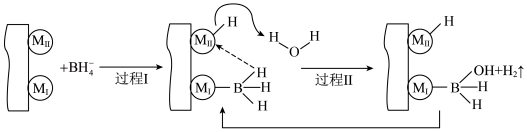
①基态Co原子的电子排布式为___________ ,其中未成对电子有___________ 个。
②过程Ⅱ中形成化学键的类型有___________ (填序号)。
A.离子键 B.金属键 C.极性键 D.非极性键
③ 最终会转化为
最终会转化为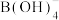 ,1个
,1个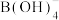 中存在
中存在___________ 个配位键。
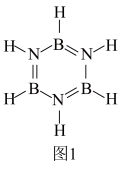
(2)有机电子器件产品环硼氮六烷的结构如图1所示,环硼氮六烷在热水中比冷水中溶解度显著增大的主要原因是___________ 。
(3)氮化硼有多种晶体结构。 是一种与金刚石类似的正四面体结构晶体;
是一种与金刚石类似的正四面体结构晶体; 是一种硼和氮原子之间的成键方式与
是一种硼和氮原子之间的成键方式与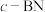 类似的晶体;
类似的晶体;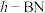 是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。
是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。

①下列有关说法,正确的是___________ (填序号)。
A.三种BN晶体中B—N键的键长相等
B.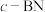 晶体的硬度较大
晶体的硬度较大
C.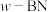 中B原子采取的杂化方式是
中B原子采取的杂化方式是
D.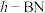 具有一定的润滑性
具有一定的润滑性
②已知氮化铝(AlN)晶体也是一种微粒之间以共价键结合的晶体,请用结构知识解释BN晶体熔点比 高的原因
高的原因___________ 。
(4)镁粉与硼粉在一定条件下可合成一种超导体,其晶胞结构如图Ⅰ、Ⅱ所示,则其化学式为___________ 。

(1)金属催化剂M(Co、Ni)催化硼氢化钠
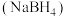 水解释放
水解释放 机理如下图所示:
机理如下图所示:
①基态Co原子的电子排布式为
②过程Ⅱ中形成化学键的类型有
A.离子键 B.金属键 C.极性键 D.非极性键
③
 最终会转化为
最终会转化为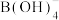 ,1个
,1个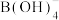 中存在
中存在(2)有机电子器件产品环硼氮六烷的结构如图1所示,环硼氮六烷在热水中比冷水中溶解度显著增大的主要原因是

(3)氮化硼有多种晶体结构。
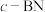 是一种与金刚石类似的正四面体结构晶体;
是一种与金刚石类似的正四面体结构晶体;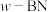 是一种硼和氮原子之间的成键方式与
是一种硼和氮原子之间的成键方式与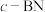 类似的晶体;
类似的晶体;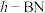 是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。
是一种类似石墨的蜂窝六边形层状结构晶体。它们的晶体结构如图2所示。
①下列有关说法,正确的是
A.三种BN晶体中B—N键的键长相等
B.
 晶体的硬度较大
晶体的硬度较大C.
 中B原子采取的杂化方式是
中B原子采取的杂化方式是
D.
 具有一定的润滑性
具有一定的润滑性②已知氮化铝(AlN)晶体也是一种微粒之间以共价键结合的晶体,请用结构知识解释BN晶体熔点比
 高的原因
高的原因(4)镁粉与硼粉在一定条件下可合成一种超导体,其晶胞结构如图Ⅰ、Ⅱ所示,则其化学式为

您最近一年使用:0次
名校
9 . 冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂。例如KMnO4水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如图。
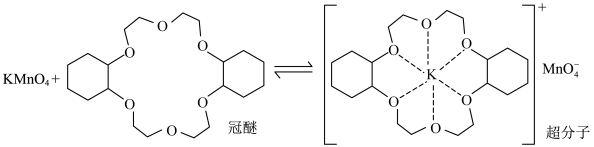
下列说法错误的是
| A.冠醚属于超分子 |
| B.冠醚中C、O原子间的化学键为σ键 |
| C.K+通过配位键与冠醚相结合 |
D.冠醚与K+结合后将 带入烯烃中, 带入烯烃中, 与烯烃充分接触而迅速反应 与烯烃充分接触而迅速反应 |
您最近一年使用:0次
名校
10 . 用H2O2氧化[Co(NH3)6]2+可得[Co(NH3)6]3+,其空间结构如图。其中1~6处的小圆圈表示NH3分子,相邻NH3分子的距离相等,中心离子Co3+位于八面体的中心,NH3分子到Co3+的距离相等(图中虚线长度相等),下列说法错误的是
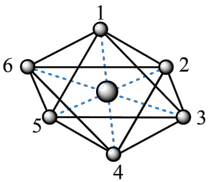

| A.H2O2为非极性分子 |
| B.NH3、H2O与Co3+形成配离子的稳定性:NH3>H2O |
| C.NH3与Co3+配位之后,∠H-N-H会变小 |
| D.若[Co(NH3)6]3+中两个NH3被Cl-替代,得到的[Co(NH3)4Cl2]+有2种结构 |
您最近一年使用:0次



