1 . 血红蛋白可与 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为
②
下列说法中错误的是
 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为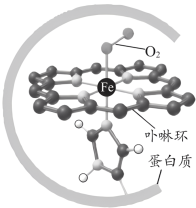

②

下列说法中错误的是
A.相同温度下, | B.反应①②的 、 、 均小于0 均小于0 |
C.图中 的配位数为6 的配位数为6 | D.用高压氧舱治疗 中毒时,平衡①②均逆向移动 中毒时,平衡①②均逆向移动 |
您最近一年使用:0次
2024-01-13更新
|
1157次组卷
|
7卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题
江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题天津市红桥区2024届高三下学期二模化学试题
2 . 汞及其化合物在催化、科学研究等方面具有重要应用。
(1)HgO可作为光催化剂降解有机染料污染物(如罗丹明B,以下简称B)。 受热分解可生成HgO,同时按物质的量之比为4:1产生两种气体。
受热分解可生成HgO,同时按物质的量之比为4:1产生两种气体。
①完成化学方程式: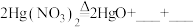
______________ 。
②在三组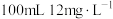 的B溶液中分别加入0.075g HgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度
的B溶液中分别加入0.075g HgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度 的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是
的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是___________ 。___________ 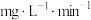 。
。
(2)乙炔(HC≡CH)能在汞盐溶液催化下与水反应生成 ,反应历程及相对能垒如下图所示。
,反应历程及相对能垒如下图所示。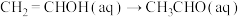

________ 。
②下列说法正确的是________ 。
A.本反应历程涉及的物质中, 最不稳定
最不稳定
B.过程①中, 的空轨道接受水分子中氧原子的孤对电子
的空轨道接受水分子中氧原子的孤对电子
C.该反应历程中,存在非极性键的断裂和形成
D.增大压强和乙炔的浓度均能加快反应速率,并且增大乙炔的平衡转化率
(3)常温下, 与
与 的配合物存在如下平衡:
的配合物存在如下平衡: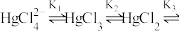
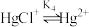 ,含Hg微粒的分布系数
,含Hg微粒的分布系数 与
与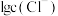 的关系如下图所示:
的关系如下图所示:
①图中能代表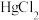 曲线是
曲线是________ (填字母),平衡常数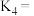
___________ 。
②在P点,溶液中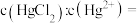
___________ 。
(1)HgO可作为光催化剂降解有机染料污染物(如罗丹明B,以下简称B)。
 受热分解可生成HgO,同时按物质的量之比为4:1产生两种气体。
受热分解可生成HgO,同时按物质的量之比为4:1产生两种气体。①完成化学方程式:
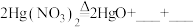
②在三组
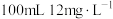 的B溶液中分别加入0.075g HgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度
的B溶液中分别加入0.075g HgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度 的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是
的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是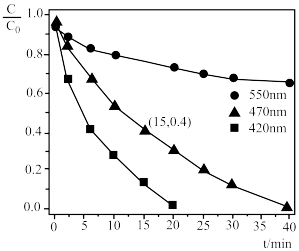
 。
。(2)乙炔(HC≡CH)能在汞盐溶液催化下与水反应生成
 ,反应历程及相对能垒如下图所示。
,反应历程及相对能垒如下图所示。
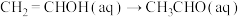

②下列说法正确的是
A.本反应历程涉及的物质中,
 最不稳定
最不稳定B.过程①中,
 的空轨道接受水分子中氧原子的孤对电子
的空轨道接受水分子中氧原子的孤对电子C.该反应历程中,存在非极性键的断裂和形成
D.增大压强和乙炔的浓度均能加快反应速率,并且增大乙炔的平衡转化率
(3)常温下,
 与
与 的配合物存在如下平衡:
的配合物存在如下平衡: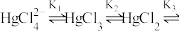
 ,含Hg微粒的分布系数
,含Hg微粒的分布系数 与
与 的关系如下图所示:
的关系如下图所示: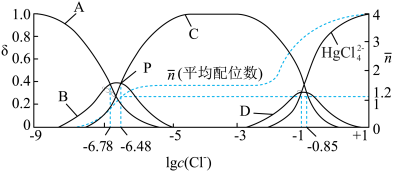

①图中能代表
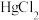 曲线是
曲线是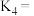
②在P点,溶液中
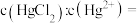
您最近一年使用:0次
2024-01-05更新
|
1021次组卷
|
3卷引用:2024届江西省吉安市第一中学高三下学期三模化学试题
名校
解题方法
3 . 下列离子方程式与所给事实不相符的是
A.用K3[Fe(CN)6]检验FeSO4中的Fe2+离子: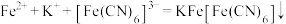 |
B.一元弱酸次磷酸(H3PO2)与足量的KOH溶液反应: |
C.向ZnS白色悬浊液中滴入CuSO4溶液生成黑色CuS沉淀: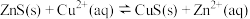 |
D.向明矾[KAl(SO4)2]溶液中滴加Ba(OH)2溶液,恰好使 沉淀完全: 沉淀完全: |
您最近一年使用:0次
2023-12-31更新
|
506次组卷
|
3卷引用:2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
4 . 冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。下列说法错误的是
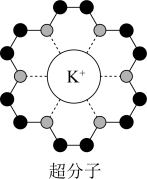
A.1mol 18-冠-6超分子中配位键数目为6 |
| B.18-冠-6可以与锂离子络合 |
C.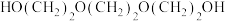 与 与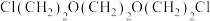 可合成18-冠-6 可合成18-冠-6 |
| D.该超分子熔点较高 |
您最近一年使用:0次
2023-12-24更新
|
270次组卷
|
2卷引用:江西省南昌市第十九中学2023-2024学年高二下学期3月月考化学试题
2024·广西·模拟预测
名校
解题方法
5 . 氧化铈(CeO2)常用作玻璃工业添加剂,在其立方晶胞中掺杂Y2O3,Y3+占据原来Ce4+的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设CeO2晶胞边长为apm,下列说法错误的是
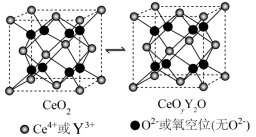

A.CeO2晶胞中 与最近 与最近 的核间距为 的核间距为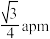 |
| B.CeO2立方晶胞中铈离子的配位数为4 |
| C.CeO2晶胞中氧离子填充在铈离子构成的四面体空隙中 |
| D.若掺杂Y2O3后得到n(CeO2)∶n(Y2O3)=0.8∶0.1的晶体,则此晶体中O2−的空缺率为5% |
您最近一年使用:0次
真题
名校
6 . 锆 是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,
是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞, 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
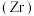 是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,
是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞, 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是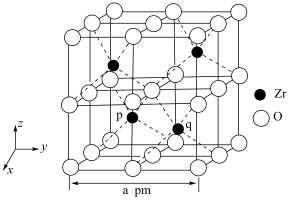
A.该氧化物的化学式为 |
B.该氧化物的密度为 |
C. 原子之间的最短距离为 原子之间的最短距离为 |
D.若坐标取向不变,将p点 原子平移至原点,则q点 原子平移至原点,则q点 原子位于晶胞 原子位于晶胞 面的面心 面的面心 |
您最近一年使用:0次
2023-11-29更新
|
5121次组卷
|
10卷引用:江西省宜春市高安市灰埠中学2023-2024学年高三上学期11月期中化学试题
江西省宜春市高安市灰埠中学2023-2024学年高三上学期11月期中化学试题(已下线)选择题11-14(已下线)微题型02 晶体结构及相关计算-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题河北省石家庄市第十七中学2023-2024高二上学期期末考试化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题2023年河北省高考化学试卷四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷(已下线)选择题11-14
7 . 物质的结构决定其性质。下列实例与解释不相符的是
| 选项 | 实例 | 解释 |
| A | 用 替代 替代 填充探空气球更安全 填充探空气球更安全 |  的电子构型稳定,不易得失电子 的电子构型稳定,不易得失电子 |
| B |  与 与 形成配合物 形成配合物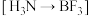 |  中的B有空轨道接受 中的B有空轨道接受 中N的孤电子对 中N的孤电子对 |
| C | 碱金属中 的熔点最高 的熔点最高 | 碱金属中 的价电子数最少,金属键最强 的价电子数最少,金属键最强 |
| D | 不存在稳定的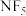 分子 分子 | N原子价层只有4个原子轨道,不能形成5个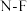 键 键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-29更新
|
4197次组卷
|
10卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题
江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题河北省石家庄市第十七中学2023-2024高二上学期期末考试化学试题海南省海南中学2023-2024学年高三上学期第5次月考化学试题2023年河北省高考化学试卷山东省德州市夏津县第一中学2023-2024学年高二下学期3月月考化学试题(已下线)选择题6-10
名校
解题方法
8 . 氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(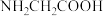 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
(1) 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为___________ (填字母序号)。 和
和 分子中均含有以N原子为中心原子的大
分子中均含有以N原子为中心原子的大 键
键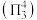 。
。
 分子中
分子中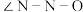
___________  分子中
分子中 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
(3)甘氨酸的晶体类型为___________ ,其中C原子的杂化方式为___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(4)三价铁的强酸盐溶于水后经水解可以生成如下图1所示的二聚体,其中 的配位数为
的配位数为___________ ,过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:① 、②
、② 、③
、③ ,该二聚体中Fe采取的杂化类型为
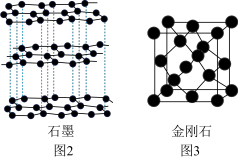
,该二聚体中Fe采取的杂化类型为___________ (填标号)。___________ 金刚石(填“>”、“<”或“=”)。若碳原子半径为a,金刚石晶胞的边长为b.计算表示碳原子在晶胞中的空间占有率___________ 。(答案写只含π的表达式)
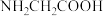 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。(1)
 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为a. b.
b.  c.
c.  d.
d.
 和
和 分子中均含有以N原子为中心原子的大
分子中均含有以N原子为中心原子的大 键
键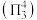 。
。 分子中
分子中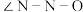
 分子中
分子中 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);(3)甘氨酸的晶体类型为
(4)三价铁的强酸盐溶于水后经水解可以生成如下图1所示的二聚体,其中
 的配位数为
的配位数为 、②
、② 、③
、③ ,该二聚体中Fe采取的杂化类型为
,该二聚体中Fe采取的杂化类型为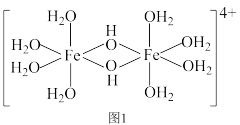
您最近一年使用:0次
2023-11-21更新
|
567次组卷
|
3卷引用:江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
9 . 关于[Co(NH3)4Cl2]Cl的说法中正确的是
| A.钴离子提供孤电子对,NH3提供空轨道 |
| B.1 mol [Co(NH3)4Cl2]Cl含有σ键的数目为18NA |
| C.配体NH3的中心原子的价层电子对数为4对,其VSEPR模型为三角锥形 |
| D.含1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液,产生3 mol白色沉淀 |
您最近一年使用:0次
2023-10-18更新
|
226次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
10 . 铝及其化合物在生产和科研中有广泛的应用。回答下列问题:
(1)Al位于元素周期表的_____ 区;基态Al原子价层电子的轨道表示式为_____ 。
(2) 是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测
是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测 的熔点比
的熔点比
_____ (填“高”或“低”),原因是_____ 。
(3) 溶解在
溶解在 溶液中可形成
溶液中可形成 (四羟基合铝酸钠)溶液,在
(四羟基合铝酸钠)溶液,在 溶液中存在的化学键有_____(填字母)。
溶液中存在的化学键有_____(填字母)。
(4)近年来,人们发现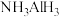 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,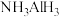 与HF形成的双氢键可表示为
与HF形成的双氢键可表示为_____ 。
(5)Al单质晶体中原子的堆积方式与干冰中 分子的相同,其晶胞如图所示。
分子的相同,其晶胞如图所示。_____ 个。
②若晶胞参数为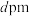 ,
, 表示阿伏伽德罗常数的值,Al单质的密度可表示为
表示阿伏伽德罗常数的值,Al单质的密度可表示为_____  (用含d和
(用含d和 代数式表示)。
代数式表示)。
(1)Al位于元素周期表的
(2)
 是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测
是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测 的熔点比
的熔点比
(3)
 溶解在
溶解在 溶液中可形成
溶液中可形成 (四羟基合铝酸钠)溶液,在
(四羟基合铝酸钠)溶液,在 溶液中存在的化学键有_____(填字母)。
溶液中存在的化学键有_____(填字母)。| A.离子键 | B.极性键 | C.非极性键 | D.配位键 | E.金属键 |
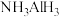 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,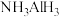 与HF形成的双氢键可表示为
与HF形成的双氢键可表示为| X—H…H—Y (“—”表示共价键,“…”表示形成的双氢键) |
 分子的相同,其晶胞如图所示。
分子的相同,其晶胞如图所示。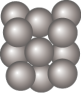
②若晶胞参数为
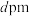 ,
, 表示阿伏伽德罗常数的值,Al单质的密度可表示为
表示阿伏伽德罗常数的值,Al单质的密度可表示为 (用含d和
(用含d和 代数式表示)。
代数式表示)。
您最近一年使用:0次
2023-08-15更新
|
207次组卷
|
3卷引用:江西省宜春市丰城拖船中学2023-2024学年高三上学期开学考试化学试题
江西省宜春市丰城拖船中学2023-2024学年高三上学期开学考试化学试题广西桂林市2022-2023学年高二下学期期末考试化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)



