2022高三·全国·专题练习
真题
解题方法
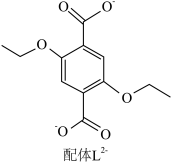
1 . 配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。______ 。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为______ 形;每个L2-中采取sp2杂化的C原子数目为______ 个,C与O之间形成σ键的数目为______ 个。
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入______ 。(假设X晶胞形状不变)。
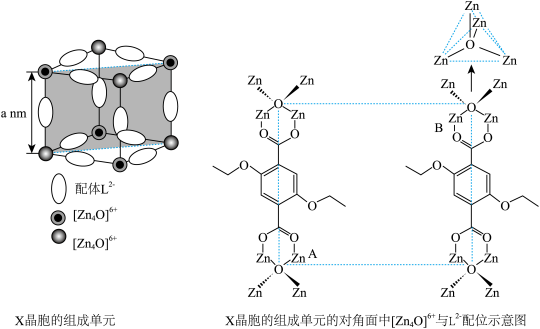
(4)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。______ 。
②X晶体中Zn2+的配位数为______ 。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为_____ nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为_____ g•cm-3(列出化简的计算式)。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
| A.-Cl | B.-OH | C.-NH2 | D.-CH3 |
②X晶体中Zn2+的配位数为
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为
您最近一年使用:0次
名校
2 . 弱碱性条件下,利用含砷氧化铜矿(含CuO、 及少量不溶性杂质)制备
及少量不溶性杂质)制备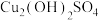 的工艺流程如下:
的工艺流程如下:
 及少量不溶性杂质)制备
及少量不溶性杂质)制备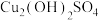 的工艺流程如下:
的工艺流程如下: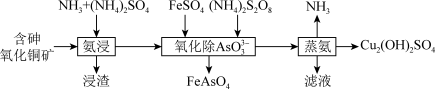
A.“氨浸”过程中, 发生的离子反应为 发生的离子反应为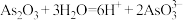 |
B.“氨浸”后的滤液中存在的阳离子主要有: 、 、 |
C.“氧化除 ”过程中,每生成 ”过程中,每生成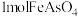 ,消耗 ,消耗 |
D.“蒸氨”后的滤液中不含有 |
您最近一年使用:0次
2023-02-17更新
|
661次组卷
|
6卷引用:重庆市第一中学校2022-2023学年高二下学期第一次月考化学试题
重庆市第一中学校2022-2023学年高二下学期第一次月考化学试题湖南省名校联盟2022-2023学年高三下学期2月联考化学试题湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)福建省德化一中、永安一中、漳平一中三校协作2023届高三下学期5月适应性考试化学试题(已下线)湖南省郴州市临武县第一中学2023-2024学年高三下学期5月期中化学试题
解题方法
3 . DNA中四种碱基间的配对方式如图(~代表糖苷键,“ ”代表氢键),下列说法错误的是
”代表氢键),下列说法错误的是
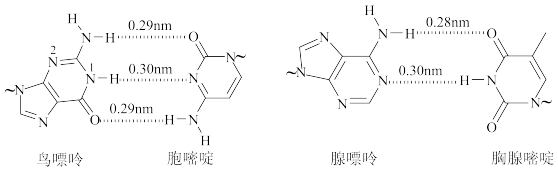
 ”代表氢键),下列说法错误的是
”代表氢键),下列说法错误的是
| A.基态原子的第一电离能:N>O | B. 与 与 通过配位键形成 通过配位键形成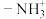 |
C.鸟嘌吟中1号N的杂化类型为 | D.鸟嘌吟中N—H键的平均键长大于0.29nm |
您最近一年使用:0次
名校
解题方法
4 . 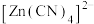 在水溶液中与HCHO发生如下反应:
在水溶液中与HCHO发生如下反应: 。下列说法正确的是
。下列说法正确的是
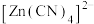 在水溶液中与HCHO发生如下反应:
在水溶液中与HCHO发生如下反应: 。下列说法正确的是
。下列说法正确的是| A.HCHO的分子构型是是三角锥形 |
B.基态 的电子排布式为 的电子排布式为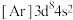 |
C.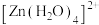 中与 中与 形成配位键的原子是H 形成配位键的原子是H |
D.1mol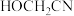 中所含 中所含 键的数目是6mol 键的数目是6mol |
您最近一年使用:0次
2022-10-07更新
|
539次组卷
|
3卷引用:重庆市万州第二高级中学2022-2023学年高三上学期1月质量检测化学试题
解题方法
5 . 下列说法或图示表达错误的是
A.基态Zn2+价层电子的轨道表示式: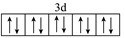 |
B.ClO 的VSEPR模型与离子的空间结构一致 的VSEPR模型与离子的空间结构一致 |
C.NaOH的电子式: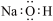 |
| D.在[Cd(NH3)4]2+中,NH3提供孤对电子,Cd2+提供空轨道 |
您最近一年使用:0次
名校
解题方法
6 . 冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与 形成的螯合离子的结构如图所示。下列说法错误的是
形成的螯合离子的结构如图所示。下列说法错误的是
 形成的螯合离子的结构如图所示。下列说法错误的是
形成的螯合离子的结构如图所示。下列说法错误的是
| A.该螯合离子所形成的物质是离子晶体,晶体中存在离子键、极性键、非极性键。 |
| B.该螯合离子有4种一氯代物,中心离子的配位数为6 |
| C.该螯合离子有分子识别和自组装的功能 |
D.该螯合离子中C原子杂化方式有2种,6个O原子与 可能在同一平面上 可能在同一平面上 |
您最近一年使用:0次
2023-04-11更新
|
454次组卷
|
4卷引用:重庆外国语学校(川外附中)、重庆市育才中学校2022-2023学年高二下学期期中联合考试化学试题
名校
7 . 钻(Co)是生产耐热介金、硬质介金、防介金、磁性合金和各种钻盐的重要原料。请回答下列问题:
(1)基态Co原子的价电子排布式为_______ 。
(2)Co同周期同族的三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______ (用化学式表示)。
(3)含钴配合物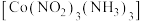 的中心离子的配位数为
的中心离子的配位数为_______ ,其中N采取的杂化类型为_______ 。
(4)钴蓝晶体结构如图所示,该立方晶胞有4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为_______ ,设阿伏加德罗常数的值为 ,该晶体密度为
,该晶体密度为_______  (列计算式)。
(列计算式)。

(1)基态Co原子的价电子排布式为
(2)Co同周期同族的三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为
(3)含钴配合物
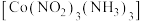 的中心离子的配位数为
的中心离子的配位数为(4)钴蓝晶体结构如图所示,该立方晶胞有4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为
 ,该晶体密度为
,该晶体密度为 (列计算式)。
(列计算式)。
您最近一年使用:0次
2022-03-05更新
|
476次组卷
|
3卷引用:重庆市缙云教育联盟2022届高三第二次诊断性检测化学试题
8 . 关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是
| A.配离子是[TiCl(H2O)5]2+,中心离子是Ti4+ |
| B.配位键中提供孤电子对的是氧原子和氯离子 |
| C.配位体是Cl-和H2O,配位数是9 |
| D.向含有1mol [TiCl(H2O)5]Cl2·H2O的溶液中加入足量AgNO3溶液,会产生3mol AgCl沉淀 |
您最近一年使用:0次
2022-04-04更新
|
504次组卷
|
4卷引用:重庆市万州纯阳中学校2021-2022学年高二下学期期中考试化学试题
名校
解题方法
9 . 下列有关化学用语的表示错误的是
A.食盐水中存在水合钠离子,其示意图为 |
B.醛基具有较强的极性,其中碳氧双键中的电荷分布示意图为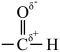 |
C.共价化合物 中所有原子均满足8电子稳定结构,其结构式为 中所有原子均满足8电子稳定结构,其结构式为 |
D.硼氢化钠(NaBH4)是有机合成中的重要还原剂,其电子式为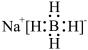 |
您最近一年使用:0次
名校
解题方法
10 . TiO2-aNb、Cu(In1-xGaxSe2)是常见的光学活性物质。请回答下列问题:
(1)基态Ti原子的电子所占据的最高能层符号为___________ ,N、O、Cu的电负性由大到小的顺序是___________ 。
(2)利用TiO2纳米管的光电实验可制备TNT(2,4,6—三硝基甲苯),其结构如图,N原子的杂化类型为___________ 。TNT常温下是固体,而甲苯是液体,原因是___________ 。
①NH3的VSEPR模型为___________ 。
②GaCl3·xNH3含有的化学键类型有___________ (填序号)。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
③能准确表示GaCl3·xNH3结构的化学式为___________ 。
(4)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。___________ g/cm3。
②图乙TiO2-aNb晶体中a=___________ 。
(1)基态Ti原子的电子所占据的最高能层符号为
(2)利用TiO2纳米管的光电实验可制备TNT(2,4,6—三硝基甲苯),其结构如图,N原子的杂化类型为

①NH3的VSEPR模型为
②GaCl3·xNH3含有的化学键类型有
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
③能准确表示GaCl3·xNH3结构的化学式为
(4)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。
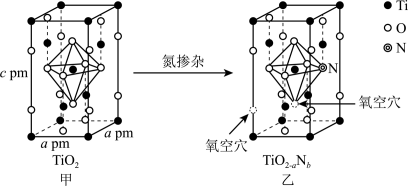
②图乙TiO2-aNb晶体中a=
您最近一年使用:0次
2021-12-22更新
|
1104次组卷
|
7卷引用:重庆市西南大学附属中学校2021- 2022学年高三下学期第六次月考化学试题
重庆市西南大学附属中学校2021- 2022学年高三下学期第六次月考化学试题四川省成都市石室中学2021-2022学年高三上学期一诊考试化学试题(已下线)【直击双一流】02-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)化学-2022年高考考前押题密卷(福建卷)新疆石河子第一中学2021-2022学年高二5月月考化学试题四川省成都市第七中学2021-2022学年高三下学期1月月考理科综合化学试题2024届四川省成都市树德中学高三下学期高考适应性考试理科综合试题-高中化学



