名校
1 . 2021年7月4日,“神舟十二号”航天员圆满完成出舱任务。“神舟十二号”制作材料中包含了 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1) 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ , 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为___________ 。
(2) 位于元素周期表的
位于元素周期表的___________ (填“ ”、“
”、“ ”、“
”、“ ”或“
”或“ ”)区,
”)区, 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
___________  (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是___________ 。
(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。 的一种螯合物结构如图1所示,
的一种螯合物结构如图1所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有___________ 个,该螯合物中 的杂化方式为
的杂化方式为___________ 。
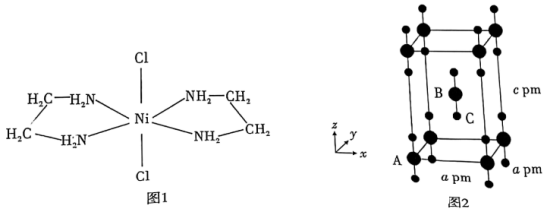
(4) 晶体属四方晶系,晶胞结构如图2所示,晶胞棱边夹角均为90°。以晶胞棱边为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
晶体属四方晶系,晶胞结构如图2所示,晶胞棱边夹角均为90°。以晶胞棱边为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,
, 点原子的分数坐标为
点原子的分数坐标为 。已知
。已知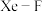 键长为
键长为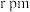 ,则
,则 点原子的分数坐标为
点原子的分数坐标为___________ ;设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 的密度为
的密度为___________  (列计算式)。
(列计算式)。
 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:(1)
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为(2)
 位于元素周期表的
位于元素周期表的 ”、“
”、“ ”、“
”、“ ”或“
”或“ ”)区,
”)区, 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。
 的一种螯合物结构如图1所示,
的一种螯合物结构如图1所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有 的杂化方式为
的杂化方式为
(4)
 晶体属四方晶系,晶胞结构如图2所示,晶胞棱边夹角均为90°。以晶胞棱边为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如
晶体属四方晶系,晶胞结构如图2所示,晶胞棱边夹角均为90°。以晶胞棱边为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如 点原子的分数坐标为
点原子的分数坐标为 ,
, 点原子的分数坐标为
点原子的分数坐标为 。已知
。已知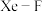 键长为
键长为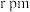 ,则
,则 点原子的分数坐标为
点原子的分数坐标为 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 的密度为
的密度为 (列计算式)。
(列计算式)。
您最近一年使用:0次
2021-10-12更新
|
279次组卷
|
2卷引用:重庆市2022届高三第二次质量检测化学试题
名校
解题方法
2 . 2020年11月24日,长征五号遥五运载火箭搭载嫦娥五号月球探测器成功发射升空并将其送入预定轨道,实现了我国首次月球无人采样返回。月球的沙土中含有丰富的钛铁矿,土壤中还含有硅、铝、钾、钡、钴、铷、汞、铜和稀土元素(如铈)等。
(1)铈外围电子排布 是原子序数为58的一种最早有实际用途的稀土元素,铈在元素周期表中属于
是原子序数为58的一种最早有实际用途的稀土元素,铈在元素周期表中属于___________ 区元素。
(2)硝酸铈铵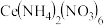 中,N的杂化方式为
中,N的杂化方式为___________ ; 、C、N、O的第一电离能由大到小的顺序为
、C、N、O的第一电离能由大到小的顺序为___________ 。
(3)钠与铝是位于同一周期的金属元素,但 的熔点(801℃)高于
的熔点(801℃)高于 (194℃),原因是
(194℃),原因是___________ ;
(4)作为过渡元素的 、
、 容易形成配位化合物:如实验室检验
容易形成配位化合物:如实验室检验 会用到
会用到 溶液,与
溶液,与 互为等电子体的分子有
互为等电子体的分子有_____ (写1种即可)。无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中微粒间不存在的作用力有______ 。
A.配位键B.金属键C.离子键D.共价键E.氢键F.范德华力
(5)钴的一种化合物晶胞结构如下图所示:

①晶胞中离 最近的O有
最近的O有___________ 个,该晶胞结构的另一种表示中, 处于各顶角位置,则O处于
处于各顶角位置,则O处于___________ 位置, 处于
处于___________ 位置。
②已知该晶体的密度为 ,则晶胞中
,则晶胞中 与O的最近距离是
与O的最近距离是___________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
(1)铈外围电子排布
 是原子序数为58的一种最早有实际用途的稀土元素,铈在元素周期表中属于
是原子序数为58的一种最早有实际用途的稀土元素,铈在元素周期表中属于(2)硝酸铈铵
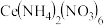 中,N的杂化方式为
中,N的杂化方式为 、C、N、O的第一电离能由大到小的顺序为
、C、N、O的第一电离能由大到小的顺序为(3)钠与铝是位于同一周期的金属元素,但
 的熔点(801℃)高于
的熔点(801℃)高于 (194℃),原因是
(194℃),原因是(4)作为过渡元素的
 、
、 容易形成配位化合物:如实验室检验
容易形成配位化合物:如实验室检验 会用到
会用到 溶液,与
溶液,与 互为等电子体的分子有
互为等电子体的分子有A.配位键B.金属键C.离子键D.共价键E.氢键F.范德华力
(5)钴的一种化合物晶胞结构如下图所示:

①晶胞中离
 最近的O有
最近的O有 处于各顶角位置,则O处于
处于各顶角位置,则O处于 处于
处于②已知该晶体的密度为
 ,则晶胞中
,则晶胞中 与O的最近距离是
与O的最近距离是 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
3 . 深紫外固体激光器可用于高温超导、催化剂研究等领域。我国自主研发的用氟硼铍酸钾(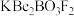 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:
(1)请画出 原子的价层电子排布图:
原子的价层电子排布图:_______ ,基态 、
、 、
、 三种元素的原子第一电离能由大到小的顺序为
三种元素的原子第一电离能由大到小的顺序为_______ , 、
、 、
、 三种晶体中熔点最高的是
三种晶体中熔点最高的是_______ 。
(2)在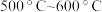 气相中,氯化铍以二聚体
气相中,氯化铍以二聚体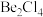 的形式存在,在该二聚体中
的形式存在,在该二聚体中 原子的杂化方式是
原子的杂化方式是_______ ,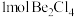 中含有的配位键数目为
中含有的配位键数目为_______ 。
(3)往硫酸铜溶液中加入过量氨水,可生成 配离子。已知
配离子。已知 与
与 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是_______ 。
(4) 晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构与
晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构与 类似,如图所示。
类似,如图所示。 原子的配位数是
原子的配位数是_______ ;该晶胞中原子的位置可以用原子分数坐标表示,若原子 ,
, 的坐标分别为
的坐标分别为 ,
,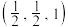 ;则
;则 原子坐标为
原子坐标为_______ 。设 与
与 的最近距离为
的最近距离为 ,用
,用 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为_______  (用含a和
(用含a和 的式子表示)。
的式子表示)。
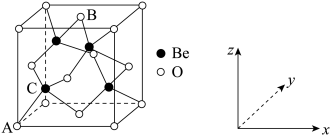
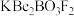 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:(1)请画出
 原子的价层电子排布图:
原子的价层电子排布图: 、
、 、
、 三种元素的原子第一电离能由大到小的顺序为
三种元素的原子第一电离能由大到小的顺序为 、
、 、
、 三种晶体中熔点最高的是
三种晶体中熔点最高的是(2)在
 气相中,氯化铍以二聚体
气相中,氯化铍以二聚体 的形式存在,在该二聚体中
的形式存在,在该二聚体中 原子的杂化方式是
原子的杂化方式是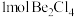 中含有的配位键数目为
中含有的配位键数目为(3)往硫酸铜溶液中加入过量氨水,可生成
 配离子。已知
配离子。已知 与
与 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是(4)
 晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构与
晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构与 类似,如图所示。
类似,如图所示。 原子的配位数是
原子的配位数是 ,
, 的坐标分别为
的坐标分别为 ,
,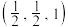 ;则
;则 原子坐标为
原子坐标为 与
与 的最近距离为
的最近距离为 ,用
,用 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。
您最近一年使用:0次
2021-09-28更新
|
372次组卷
|
3卷引用:重庆市巴蜀中学2022届高三适应性月考(二)化学试题
4 . 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
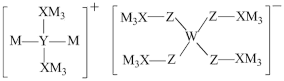
A.氢化物沸点: | B.原子半径: |
C.第一电离能: | D.阴、阳离子中均有配位键 |
您最近一年使用:0次
2021-09-13更新
|
12025次组卷
|
34卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题
重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题2021年新高考辽宁化学高考真题湖北省华中师范大学第一附属中学2021-2022学年高二上学期期中检测化学试题2021年辽宁高考化学试题变式题11-19辽宁省朝阳市建平县实验中学2021-2022学年高二下学期第一次月考化学试题福建省厦门集美中学2021-2022学年高二下学期第一次月考化学试题浙江省宁波市六校2021-2022学年高二下学期期中联考化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2022届高三下学期5月月考化学试题(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)专题讲座(五) “位-构-性”综合推断题的解题方法(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题(已下线)题型78 基于物质结构考查元素周期律北京市平谷区2022-2023学年高三下学期质量监控(零模)化学试题山西省太原市第五中学2022-2023学年高二下学期3月月考化学试题(已下线)专题07 元素周期表与元素周期律河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题黑龙江省富锦市第一中学2022-2023学年高二下学期第二次考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖北武汉市硚口区2023-2024学年高三起点质量检测化学试题吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题辽宁省六校协作体2023-2024学年高三上学期11月期中考试化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建天津市第四中学2023-2024学年高三上学期第二次月考化学试卷湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题(已下线)选择题6-10福建省泉州市泉港区第一中学2023-2024学年高二下学期3月月考化学试题(已下线)选择题6-10
名校
5 . 有机金属化合物的应用研究是目前科学研究的前沿之一、二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如图所示。回答下列问题。
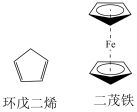
(1)环戊二烯分子中σ键和π键的个数比为___________ 。
(2)下列关于环戊二烯和二茂铁的说法不正确的是___________ (填字母序号)。
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式___________ 。
(4)已知环戊二烯阴离子(C5H )的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有
)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有___________ (填字母序号)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:

①金刚烷的分子式为___________ ,反应①的反应类型是___________ 。
②金刚烷的二氯代物有___________ 种(不考虑立体异构)。
③二聚环戊二烯有多种同分异构体。写出一种符合下列条件的二聚环戊二烯的同分异构体的结构简式___________ 。
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。

(1)环戊二烯分子中σ键和π键的个数比为
(2)下列关于环戊二烯和二茂铁的说法不正确的是
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式
(4)已知环戊二烯阴离子(C5H
 )的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有
)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:

①金刚烷的分子式为
②金刚烷的二氯代物有
③二聚环戊二烯有多种同分异构体。写出一种符合下列条件的二聚环戊二烯的同分异构体的结构简式
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。
您最近一年使用:0次
名校
解题方法
6 . 材料是人类文明进步的阶梯,第ⅢA族、ⅣA族、VA族及Ⅷ族元素是组成特殊材料的重要元素。回答下列问题:
(1)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的核外电子数为___________ 。
(2)经测定发现,N2O5固体由NO 和NO
和NO 两种离子组成,该固体中N原子杂化类型有
两种离子组成,该固体中N原子杂化类型有___________ 。
(3)K4[Fe(CN)6]溶液可以检验铁陨石中铁元素的价态。1mol K4[Fe(CN)6]含σ键的物质的量为___________ ,化合物K4[Fe(CN)6]中存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
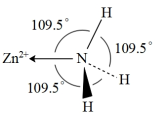
(4)NH3分子在独立存在时H−N−H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H−N−H键角的测量值。解释NH3形成如图配合物后H−N−H键角变大的原因:___________ 。
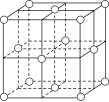
(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为___________ (填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏加德罗常数的值,则该晶胞的密度为___________ g/cm3。
(1)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的核外电子数为
(2)经测定发现,N2O5固体由NO
 和NO
和NO 两种离子组成,该固体中N原子杂化类型有
两种离子组成,该固体中N原子杂化类型有(3)K4[Fe(CN)6]溶液可以检验铁陨石中铁元素的价态。1mol K4[Fe(CN)6]含σ键的物质的量为
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)NH3分子在独立存在时H−N−H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H−N−H键角的测量值。解释NH3形成如图配合物后H−N−H键角变大的原因:

(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为

您最近一年使用:0次
2021-07-24更新
|
339次组卷
|
2卷引用:重庆育才中学高2021届高亖下学期二诊模拟考试化学试题
名校
解题方法
7 . B和Ni均为新材料的主角。回答下列问题:
(1)基态B原子的核外电子有___________ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为___________ 。
(2)硼的卤化物的沸点如表所示:
解释表中卤化物之间沸点差异的原因___________ 。
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为___________ ;Ni(PPh3)2晶体中存在的化学键类型有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++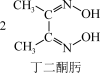

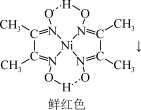 +2H+
+2H+
在1mol鲜红色沉淀中,含有sp2杂化原子的数目为___________ 个(阿伏加德罗常数的值为NA)。丁二酮肟中,各元素电负性由大到小的顺序为___________ (用元素符号表示)。
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=___________ g·cm-3。
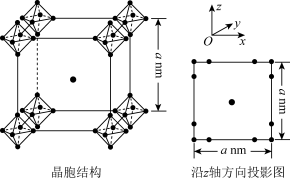
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
解释表中卤化物之间沸点差异的原因
(3)镍及其化合物常用作有机合成的催化剂,如Ni(PPh3)2,其中Ph表示苯基,PPh3表示分子,PPh3的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(4)鉴定Ni2+的特征反应如下:
Ni2++


 +2H+
+2H+在1mol鲜红色沉淀中,含有sp2杂化原子的数目为
(5)硼化钙可用于新型半导体材料,一种硼化钙的晶胞结构及沿z轴方向的投影图如图所示,硼原子形成的正八面体占据顶角位置。若阿伏加德罗常数的值为NA,晶体密度ρ=

您最近一年使用:0次
2021-07-23更新
|
456次组卷
|
3卷引用:重庆育才中学高2021届高三下学期三诊模拟考试化学试题
8 . 胆矾的化学式为CuSO4·5H2O,可改写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法正确的是

下列有关胆矾的说法正确的是
| A.氧原子参与形成配位键和氢键两种化学键 |
| B.胆矾可用于实验过程中检验水蒸气 |
| C.胆矾中的水分子均与中心Cu2+之间存在配位键 |
| D.胆矾中的水分子在不同温度下会分步失去 |
您最近一年使用:0次
名校
解题方法
9 . 铬、铁、钴等均为常见的过渡元素,回答以下问题:
(1)铬在元素周期表中的位置为_______ ,基态铬原子最外层电子所占的原子轨道形状为_______ 。铬元素形成的配合物 (相对分子质量为266.5),有多种异构体,且配位数均为6。现取
(相对分子质量为266.5),有多种异构体,且配位数均为6。现取 配成溶液,滴加足量
配成溶液,滴加足量 溶液,经过滤、洗涤、干燥、称量得到沉淀
溶液,经过滤、洗涤、干燥、称量得到沉淀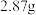 。该配合物的化学式为
。该配合物的化学式为_______ (填化学式)。该配合物内界水分子的 键角
键角_______ (填“大于”、“小于”或“等于”)水分子独立存在时 键角。
键角。
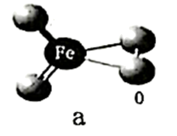
(2)铁原子结构示意图为_______ 。量子化学计算预测未知化合物是现代化学发展的途径之一,有人通过计算预言铁也存在四氧化物,该分子模型如图a,则化合物中铁微粒的价电子轨道表示式_______ 。 )与钴为同族元素,其核外电子占据最高能层的符号为
)与钴为同族元素,其核外电子占据最高能层的符号为 ,则基态
,则基态 原子的价电子排布式为
原子的价电子排布式为_______ ,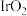 晶体的四方晶胞如图b,已知晶胞参数为
晶体的四方晶胞如图b,已知晶胞参数为 、
、 、
、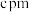 ,
,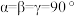 ,
, 为阿伏加德常数,则该晶体密度
为阿伏加德常数,则该晶体密度
_______  。
。
(1)铬在元素周期表中的位置为
 (相对分子质量为266.5),有多种异构体,且配位数均为6。现取
(相对分子质量为266.5),有多种异构体,且配位数均为6。现取 配成溶液,滴加足量
配成溶液,滴加足量 溶液,经过滤、洗涤、干燥、称量得到沉淀
溶液,经过滤、洗涤、干燥、称量得到沉淀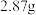 。该配合物的化学式为
。该配合物的化学式为 键角
键角 键角。
键角。(2)铁原子结构示意图为
 )与钴为同族元素,其核外电子占据最高能层的符号为
)与钴为同族元素,其核外电子占据最高能层的符号为 ,则基态
,则基态 原子的价电子排布式为
原子的价电子排布式为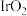 晶体的四方晶胞如图b,已知晶胞参数为
晶体的四方晶胞如图b,已知晶胞参数为 、
、 、
、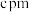 ,
,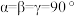 ,
, 为阿伏加德常数,则该晶体密度
为阿伏加德常数,则该晶体密度
 。
。
您最近一年使用:0次
2021-07-01更新
|
122次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
10 . 配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法正确的是
| A.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe2+,配位数为6 |
| B.向该配合物的溶液中滴加NaOH溶液,有红褐色沉淀产生 |
| C.该物质存在金属键 |
| D.该配合物为离子化合物,易电离,1mol配合物电离得到的离子数为3NA |
您最近一年使用:0次
2021-06-28更新
|
166次组卷
|
2卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题



