名校
解题方法
1 . ①NH3 ②CO2 ③SiCl4 ④BF3 ⑤C2H4 ⑥H2O2 ⑦Cl2 ⑧P4 ⑨H2S
(1)含极性共价键的非极性分子___________ (填序号,下同)
(2)含非极性共价键的非极性分子___________
(3)含极性共价键的极性分子___________
(4)①NH3中心原子杂化方式___________ 分子的空间构型___________
(5)④BF3中心原子杂化方式___________ 分子的空间构型___________
(1)含极性共价键的非极性分子
(2)含非极性共价键的非极性分子
(3)含极性共价键的极性分子
(4)①NH3中心原子杂化方式
(5)④BF3中心原子杂化方式
您最近一年使用:0次
名校
2 . 关于CH3CH3、CH3-O-CH3和CH3CHO的结构与性质,下列说法正确的是
| A.三种有机物中碳原子的杂化方式完全相同 |
| B.CH3- O- CH3和CH3CH3均为非极性分子 |
| C.CH3CHO分子中所有原子共平面 |
| D.三种分子形成的晶体均为分子晶体 |
您最近一年使用:0次
2022-06-06更新
|
362次组卷
|
4卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题
黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题湖北省华中师范大学第一附属中学2022届高三学业水平等级考试模拟演练(二)化学试题(已下线)第37讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题6-10)
名校
3 . 氢气是清洁能源之一,解决氢气的存储问题是当今科学界需要攻克的课题。C16S8是新型环烯类储氢材料,利用物理吸附的方法来储存氢分子,其分子结构如图所示,下列相关说法正确的是
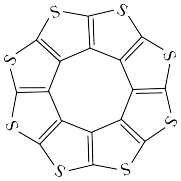
| A.C16S8的熔点由所含的化学键键能决定 |
| B.C16S8完全燃烧的产物均为极性分子 |
| C.分子中的σ键和π键的数目比为4:1 |
| D.C16S8储氢时与H2间的作用力为氢键 |
您最近一年使用:0次
2022-05-05更新
|
148次组卷
|
4卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二6月月考化学试题
名校
解题方法
4 . 2022年北京冬奥会已经成功落下帷幕,它的成功举办离不开各种科技力量的支撑。下列说法正确的是
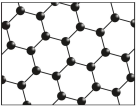

| A.跨临界直接制冰使用的CO2分子中含有非极性键 |
| B.滑冰场上的冰中水分子的稳定性低于甲烷 |
| C.颁奖礼服内胆中添加了石墨烯(结构如图),其中C原子的杂化方式是sp3杂化 |
| D.闭幕式中,鸟巢上空绽放的璀璨焰火与原子核外电子发生跃迁释放能量有关 |
您最近一年使用:0次
2022-04-23更新
|
497次组卷
|
7卷引用:黑龙江省佳木斯市第八中学2021-2022学年高二下学期期中考试化学试题
名校
5 . 影响物质在水中的溶解程度的因素有很多,下列关于溶解的说法错误的是
| A.分子晶体溶于水,会破坏分子间作用力,分子间作用力越大,溶解度可能越小 |
| B.能形成分子间氢键的物质常温下在水中的溶解度一定很大 |
| C.极性分子在水中的溶解度一般比较大 |
| D.物质溶于水有可能破坏化学键,甚至形成新的化学键 |
您最近一年使用:0次
2022-03-18更新
|
307次组卷
|
2卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题
名校
6 . 有学者提出一种 催化下炔烃羰基化的反应机理(如图所示)。下列说法错误的是
催化下炔烃羰基化的反应机理(如图所示)。下列说法错误的是
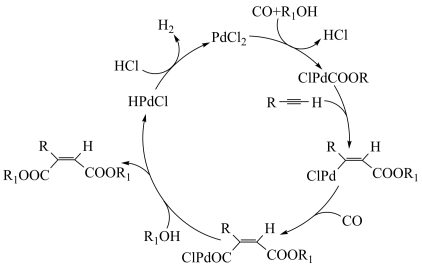
 催化下炔烃羰基化的反应机理(如图所示)。下列说法错误的是
催化下炔烃羰基化的反应机理(如图所示)。下列说法错误的是
A.反应过程中 的成键数目保持不变 的成键数目保持不变 |
B.炔烃羰基化反应为 +2CO+2R1OH +2CO+2R1OH 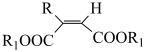 +H2 +H2 |
| C.反应过程中存在加成反应和酯化反应 |
| D.反应过程中存在非极性键的断裂和极性键的形成 |
您最近一年使用:0次
2021-12-24更新
|
359次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期1月期末考试化学试题
解题方法
7 . 已知H与O可以形成 和
和 两种化合物。请完成下列空白:
两种化合物。请完成下列空白:
(1) 内的O—H、水分子间的范德华力和氢键,从强到弱依次为
内的O—H、水分子间的范德华力和氢键,从强到弱依次为___________ 。 可与
可与 形成
形成 ,
, 中O采用
中O采用___________ 杂化。 中
中 键角比
键角比 中的
中的___________ ,原因为___________ 。
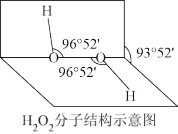
(2) 是常用的氧化剂,其分子结构如图所示,两个氢原子犹如在半展开的书的两面上。
是常用的氧化剂,其分子结构如图所示,两个氢原子犹如在半展开的书的两面上。 的电子式是
的电子式是___________ ,结构式是___________ 。 是含有
是含有___________ 键和___________ 键的分子(填“极性”或“非极性”)。 能与水混溶,却不溶于
能与水混溶,却不溶于 。请予以解释:
。请予以解释:___________ 。
 和
和 两种化合物。请完成下列空白:
两种化合物。请完成下列空白:(1)
 内的O—H、水分子间的范德华力和氢键,从强到弱依次为
内的O—H、水分子间的范德华力和氢键,从强到弱依次为 可与
可与 形成
形成 ,
, 中O采用
中O采用 中
中 键角比
键角比 中的
中的(2)
 是常用的氧化剂,其分子结构如图所示,两个氢原子犹如在半展开的书的两面上。
是常用的氧化剂,其分子结构如图所示,两个氢原子犹如在半展开的书的两面上。 的电子式是
的电子式是 是含有
是含有 能与水混溶,却不溶于
能与水混溶,却不溶于 。请予以解释:
。请予以解释:
您最近一年使用:0次
2021-12-03更新
|
1147次组卷
|
2卷引用:黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题
8 . SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是
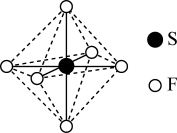
| A.是非极性分子 | B.键角 都等于90° 都等于90° |
C. 与 与 之间共用电子对偏向S 之间共用电子对偏向S | D. 原子满足8电子稳定结构 原子满足8电子稳定结构 |
您最近一年使用:0次
2021-10-23更新
|
8380次组卷
|
32卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题
黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题2021年新高考海南化学高考真题2021年海南高考化学试题变式题1-10(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省厦门市第一中学2021-2022学年高二下学期3月适应性练习化学试题辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题(已下线)秘籍03 化学用语-备战2022年高考化学抢分秘籍(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)第30讲 分子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题辽宁省大石桥市第三高级中学2021-2022学年高三12月月考化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)巩固训练7(已下线)题型91 分子的极性与共价键的极性判断浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)第21讲分子结构与性质(已下线)第4讲 空间构型(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海中学东校2023-2024学年高三上学期9月月考化学试题海南省文昌中学2023-2024学年高二下学期第一次月考化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题重庆市第一中学校2023-2024学年高一下学期定时练习化学试题
名校
解题方法
9 . 已知A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A的一种核素中子数是质子数的2倍;B含有3个能级,且每个能级所含的电子数相同;D原子基态核外电子运动状态共8种;E为VIII族元素,基态E原子中有4个未成对电子且全在同一能级;E、F原子序数相差3。
(1)写出阳离子E2+的核外电子排布式_______ 。
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是_______ 。(用化学式书写)
(3)由A、B、C、D构成的物质(ADBC)的结构式是_______ ,其中B原子的杂化方式是_______ ,根据等电子体原理,可推测BCD-离子的空间构型是_______ 。
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为___ 。
(5)B、C与A可以形成多种分子,有关说法不正确的是_______ 。
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。
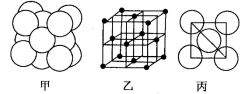
若F原子半径为acm,则F单质晶体的密度为_______ g·cm-3(只列出计算式,阿伏加德罗常数的值为NA)。
(1)写出阳离子E2+的核外电子排布式
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是
(3)由A、B、C、D构成的物质(ADBC)的结构式是
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为
(5)B、C与A可以形成多种分子,有关说法不正确的是
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。

若F原子半径为acm,则F单质晶体的密度为
您最近一年使用:0次
2021-08-03更新
|
231次组卷
|
2卷引用:黑龙江省大庆市2020届高三第一次质量检测化学试题
名校
解题方法
10 . 物质的组成和结构决定着物质的性质与变化,下列有关结构和性质的说法正确的是
| A.CO2分子中存在极性共价键,所以CO2为极性分子 |
| B.金属Li中的金属键比金属K中的金属键强,所以单质Li的还原性比K强 |
| C.邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,所以前者的熔点高于后者 |
| D.乙烯分子中两个碳原子间以sp2杂化轨道形成的σ键较稳定,未杂化的2p轨道形成的π键易断裂,所以易发生加成反应 |
您最近一年使用:0次
2021-07-01更新
|
312次组卷
|
5卷引用:黑龙江省牡丹江市第三高级中学2021-2022学年高二下学期期中考试化学试题



