名校
解题方法
1 . 有A、B、C、D四种短周期元素,A元素的气态氢化物分子式为AH4,其中A元素的质量分数为75%,该元素原子核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫_______ ,其晶体类型是_______ 。
(2)B的氢化物电子式为_______ ,属_______ (填“极性”或“非极性”)分子。
(3)A和B形成化合物的分子空间构型是_______ ,属_______ 分子,其晶体类型是_______ 。
(4)C元素位于周期表中第_______ 周期_______ 族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列_______ (用分子式表示)。
(1)A元素的一种无色透明的单质,名称叫
(2)B的氢化物电子式为
(3)A和B形成化合物的分子空间构型是
(4)C元素位于周期表中第
您最近一年使用:0次
2 . 在某温度下,5L密闭容器内发生如下反应:CH4(g)+H2O (g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)反应中的非极性分子为:______ 、______ 。
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式______ ,当温度升高,该平衡常数______ (填“增大”、“减小”或“不变”)。
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为______ 。
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
(5)在某一时刻,v正=v逆=v,此时反应达到平衡。若改变一条件,可使得v正<v逆<v,指出可以改变的条件______ ,并说明理由:__________________ 。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)= ______ 时,平衡时CO与H2的转化率相同。
 CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0(1)反应中的非极性分子为:
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
| A.氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均分子量 |
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2
 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)=
您最近一年使用:0次
名校
解题方法
3 . 化学反应中既有物质变化,也有能量变化。这些变化与化学反应的条件、限度、速率等因素有关。
(1)已知NH4F溶液呈酸性,则水解程度
___________ F-(填“>”、“<”或“=”),稀释后溶液中 的值将会
的值将会 ___________ (填“增大”、“减小”或“不变”)。
(2)某温度下,在体积为5L的密闭容器内发生如下反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在上述反应的反应物与生成物中,非极性分子为:___________ 。
②上述反应中各物质反应速率之间的关系为:___________ 。
③若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为___________ 。
④下列选项中的物理量不变时,一定可以判断反应达到平衡的是___________ 。
A.容器内氢元素的质量分数
B.容器内气体的密度
C.容器内气体的压强
D.容器内气体的平均相对分子质量
⑤在某一时刻,v正=v逆=v0,反应若改变某一条件,可使得v正<v逆<v0,指出可以改变的条件___________ 。
⑥已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH,若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=___________ 。
(1)已知NH4F溶液呈酸性,则水解程度

 的值将会
的值将会 (2)某温度下,在体积为5L的密闭容器内发生如下反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在上述反应的反应物与生成物中,非极性分子为:
②上述反应中各物质反应速率之间的关系为:
③若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为
④下列选项中的物理量不变时,一定可以判断反应达到平衡的是
A.容器内氢元素的质量分数
B.容器内气体的密度
C.容器内气体的压强
D.容器内气体的平均相对分子质量
⑤在某一时刻,v正=v逆=v0,反应若改变某一条件,可使得v正<v逆<v0,指出可以改变的条件
⑥已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH,若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
4 . 已知运送卫星的火箭所需燃料除液态过氧化氢外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的结构式为______ ,其中N原子采取_____ 杂化方式,该分子是_____ (填“极性”或“非极性”)分子。
(2)若该物质与液态过氧化氢恰好完全反应,产生两种无毒又不污染环境的气态物质,在该反应的反应物和生成物中既含有极性键又含有非极性键的是______ ,只含有非极性键的是_____ ,只含有极性键的是______ 。
(1)该氮氢化合物的结构式为
(2)若该物质与液态过氧化氢恰好完全反应,产生两种无毒又不污染环境的气态物质,在该反应的反应物和生成物中既含有极性键又含有非极性键的是
您最近一年使用:0次
5 . 硼元素在地壳中的含量仅为 ,但它却有着种类繁多的化合物。
,但它却有着种类繁多的化合物。
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ;基态 原子的核外电子运动状态有
原子的核外电子运动状态有___________ 种。
(2)根据 的解离反应:
的解离反应: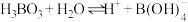 ,
,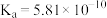 ,可判断
,可判断 是
是___________ 酸, 离子的VSEPR模型为
离子的VSEPR模型为___________ ,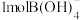 离子中含有
离子中含有___________  键。
键。
(3)分子式为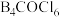 的化合物的结构如图,其中
的化合物的结构如图,其中 原子的杂化类型是
原子的杂化类型是___________ ,B-B-B键的键角___________ 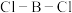 的键角(填“>”“<”或“=”)。
的键角(填“>”“<”或“=”)。

(4)在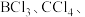 和
和 三种分子中,属于极性分子的是
三种分子中,属于极性分子的是___________ ,多原子分子中各原子若在同一平面,且有相互平行的 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,上述三种分子中存在“离域
键”,上述三种分子中存在“离域 键”的是
键”的是___________ 。
 ,但它却有着种类繁多的化合物。
,但它却有着种类繁多的化合物。(1)基态
 原子的电子排布式为
原子的电子排布式为 原子的核外电子运动状态有
原子的核外电子运动状态有(2)根据
 的解离反应:
的解离反应: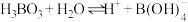 ,
,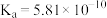 ,可判断
,可判断 是
是 离子的VSEPR模型为
离子的VSEPR模型为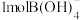 离子中含有
离子中含有 键。
键。(3)分子式为
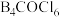 的化合物的结构如图,其中
的化合物的结构如图,其中 原子的杂化类型是
原子的杂化类型是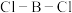 的键角(填“>”“<”或“=”)。
的键角(填“>”“<”或“=”)。
(4)在
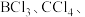 和
和 三种分子中,属于极性分子的是
三种分子中,属于极性分子的是 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,上述三种分子中存在“离域
键”,上述三种分子中存在“离域 键”的是
键”的是
您最近一年使用:0次
6 . 烟道气中含有 ,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。

(1)写出 的电子式
的电子式___________ ;
(2)下列叙述正确的是___________ ;
A.烟道气中的 含量可用一定体积、浓度的酸性高锰酸钾溶液测定
含量可用一定体积、浓度的酸性高锰酸钾溶液测定
B. 是橡胶硫化剂,橡胶硫化程度越高,弹性越好
是橡胶硫化剂,橡胶硫化程度越高,弹性越好
C. 可与
可与 发生反应,能作为
发生反应,能作为 的脱水剂
的脱水剂
D. 固体中含阳离子
固体中含阳离子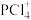 和阴离子
和阴离子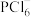 ,
,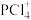 空间构型为正四面体
空间构型为正四面体
E. 易溶于
易溶于 ,则
,则 为非极性分子
为非极性分子
(3) 与过量
与过量 反应的化学方程式
反应的化学方程式___________ ;
(4) 与
与 反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为
反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为___________ ;
(5)设计实验检验 与足量NaOH溶液反应生成的阴离子
与足量NaOH溶液反应生成的阴离子___________ 。
 ,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
(1)写出
 的电子式
的电子式(2)下列叙述正确的是
A.烟道气中的
 含量可用一定体积、浓度的酸性高锰酸钾溶液测定
含量可用一定体积、浓度的酸性高锰酸钾溶液测定B.
 是橡胶硫化剂,橡胶硫化程度越高,弹性越好
是橡胶硫化剂,橡胶硫化程度越高,弹性越好C.
 可与
可与 发生反应,能作为
发生反应,能作为 的脱水剂
的脱水剂D.
 固体中含阳离子
固体中含阳离子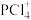 和阴离子
和阴离子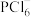 ,
,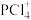 空间构型为正四面体
空间构型为正四面体E.
 易溶于
易溶于 ,则
,则 为非极性分子
为非极性分子(3)
 与过量
与过量 反应的化学方程式
反应的化学方程式(4)
 与
与 反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为
反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为(5)设计实验检验
 与足量NaOH溶液反应生成的阴离子
与足量NaOH溶液反应生成的阴离子
您最近一年使用:0次
7 . 已知A、B、C、D、E是原子序数依次增大的短周期主族元素,A是宇宙中含量最多的元素,B元素的基态原子最高能级不同轨道都有电子,且自旋方向相同,C元素基态原子的电子填充了3个能级,其中有2个未成对电子,E元素基态原子最外层只有一个电子,且次外层所有轨道电子均成对。下列说法正确的是
| A.BD3是非极性分子 | B.最低价氢化物的沸点:B>C |
| C.A与E通过离子键形成化合物 | D.B、C、E组成的化合物水溶液一定呈碱性 |
您最近一年使用:0次
解题方法
8 . 硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在。斜方硫、单斜硫是常见的两种单质。常见的含硫矿物有硫磺矿、黄铁矿 、石膏
、石膏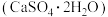 等。黄铁矿遇酸会生成硫化氢气体。工业利用黄铁矿与空气高温反应得到
等。黄铁矿遇酸会生成硫化氢气体。工业利用黄铁矿与空气高温反应得到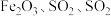 与
与 在
在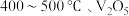 催化作用下反应生成
催化作用下反应生成 ,每生成
,每生成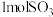 释放出
释放出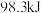 的热量,生成的
的热量,生成的 用
用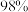 的浓硫酸吸收。利用酸性
的浓硫酸吸收。利用酸性 溶液可测定工业尾气中
溶液可测定工业尾气中 的含量。下列说法正确的是
的含量。下列说法正确的是
 、石膏
、石膏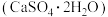 等。黄铁矿遇酸会生成硫化氢气体。工业利用黄铁矿与空气高温反应得到
等。黄铁矿遇酸会生成硫化氢气体。工业利用黄铁矿与空气高温反应得到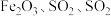 与
与 在
在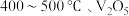 催化作用下反应生成
催化作用下反应生成 ,每生成
,每生成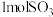 释放出
释放出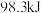 的热量,生成的
的热量,生成的 用
用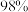 的浓硫酸吸收。利用酸性
的浓硫酸吸收。利用酸性 溶液可测定工业尾气中
溶液可测定工业尾气中 的含量。下列说法正确的是
的含量。下列说法正确的是| A.富氧地表附近含硫化合物中硫为正价、氧为负价是因为硫的电负性小于氧 |
| B.斜方硫、单斜硫是硫的两种同位素 |
C. 和 和 中心原子的杂化轨道类型相同 中心原子的杂化轨道类型相同 |
D. 中既有离子键又有非极性共价键 中既有离子键又有非极性共价键 |
您最近一年使用:0次
名校
9 . 短周期主族元素X、Y、Z、U、V的原子序数依次增大,其中Y和V同主族,Z为同周期中原子半径最大的金属元素。X的气态氢化物能与其最高价氧化物对应的水化物化合生成离子化合物,U为地壳中含量最高的金属元素,V的单质常用于自来水的杀菌消毒。下列说法正确的是
| A.简单离子半径:Y>Z>V |
B.X、V的气态氢化物发生反应,产物的电子式为 |
| C.X、Y形成的化合物为非极性分子 |
| D.U的化合物熔点:氧化物>氯化物 |
您最近一年使用:0次
2023-11-06更新
|
154次组卷
|
3卷引用:河南省部分学校2023-2024学年高三上学期一轮复习摸底测试(三)化学试题
名校
解题方法
10 . Ⅰ.元素周期表的确立是化学发展史上的里程碑。我们往往可以通过元素在周期表中的位置,对某些不熟悉元素的性质及用途做出预测。
(1)下列具有特殊性能的材料中,由主族元素和副族元素形成化合物的是_____
(2)下列事实不能用元素周期律解释的是___________
(3)短周期元素 X、Y、Z、M、N、W原子序数依次递增,六种元素形成的一种化合物结构如图所示,其中元素Z最外层电子数为内层电子数的3倍。下列说法正确的是_________

Ⅱ.在地壳里硅的含量在所有元素中居第二位,仅次于氧。接下来我们尝试利用元素周期表,通过与其相邻元素类比来了解硅的一些特点。
(4)硅在元素周期表中位于第___________ 周期___________ 族。
(5)晶体硅的结构和金刚石结构相似,碳化硅(SiC)也是一种具有类似于金刚石结构的晶体,其中碳原子核硅原子的位置是交替的。在①金刚石,②晶体硅,③碳化硅这三种晶体中,它们的熔点从高到低的顺序是___________
(6)与铝类似,硅也能溶于强碱溶液并生成硅酸根(SiO )。写出硅与氢氧化钠反应的离子方程式:
)。写出硅与氢氧化钠反应的离子方程式:___________ 。
(7)比较元素非金属性:Si___________ P(选填“<”或“>”),给出一个可以用来说明该结论的化学事实是:___________ 。
(8)二氧化硅一般不能与酸反应,但可以与氢氟酸发生如下反应:SiO2+4HF=SiF4↑+2H2O,二氧化硅属于___________ (选填“酸性”、“碱性”或“两性”)氧化物。该反应涉及的所有元素中原子半径最小的是___________ (填元素符号),生成物中属于极性分子的是___________ (填化学式)。
(1)下列具有特殊性能的材料中,由主族元素和副族元素形成化合物的是_____
| A.半导体材料砷化镓 | B.吸氢材料镧镍合金 |
| C.透明陶瓷材料硒化锌 | D.超导材料K3C60 |
(2)下列事实不能用元素周期律解释的是___________
| A.F2在暗处遇 H2爆炸,I2在暗处遇H2几乎不反应 |
| B.Br2和 NaI溶液发生置换反应,和 NaCl溶液不发生置换反应 |
| C.金属 Na 和熔融KCl反应置换出金属K |
| D.常温下,NaCl溶液的 pH=7, AlCl₃溶液的 pH<7 |
(3)短周期元素 X、Y、Z、M、N、W原子序数依次递增,六种元素形成的一种化合物结构如图所示,其中元素Z最外层电子数为内层电子数的3倍。下列说法正确的是_________

| A. 最高价氧化物对应水化物的酸性 W>Y>N |
| B. 元素Z与其他五种元素均可形成2种及以上化合物 |
| C. 简单离子半径Z>M>W |
| D. 元素 X与其他五种元素均可形成共价化合物 |
Ⅱ.在地壳里硅的含量在所有元素中居第二位,仅次于氧。接下来我们尝试利用元素周期表,通过与其相邻元素类比来了解硅的一些特点。
(4)硅在元素周期表中位于第
(5)晶体硅的结构和金刚石结构相似,碳化硅(SiC)也是一种具有类似于金刚石结构的晶体,其中碳原子核硅原子的位置是交替的。在①金刚石,②晶体硅,③碳化硅这三种晶体中,它们的熔点从高到低的顺序是___________
| A.①③② | B.③②① | C.③①② | D.②①③ |
(6)与铝类似,硅也能溶于强碱溶液并生成硅酸根(SiO
 )。写出硅与氢氧化钠反应的离子方程式:
)。写出硅与氢氧化钠反应的离子方程式:(7)比较元素非金属性:Si
(8)二氧化硅一般不能与酸反应,但可以与氢氟酸发生如下反应:SiO2+4HF=SiF4↑+2H2O,二氧化硅属于
您最近一年使用:0次



