名校
1 . 氮化硅(S3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g) S3N4(s)+6CO(g)-Q(Q>0)。完成下列填空:
S3N4(s)+6CO(g)-Q(Q>0)。完成下列填空:
(1)上述反应所涉及的元素,原子半径由小到大的顺序是____ 。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式____ 。
(2)比较碳、氮两种元素的非金属性强弱,可以通过化学反应____ (写方程式)来判断。分析用氮化硅制造发动机中耐热部件的原因是___ 。
(3)上述反应混合物中极性分子是___ ,写出非极性分子的电子式___ 。
(4)Na2CO3又称纯碱,用电离平衡原理说明Na2CO3溶液呈碱性的原因__ ;若将Na2CO3与NaHCO3溶液等体积混合后,所得溶液中c(CO )=c(HCO
)=c(HCO ),则混合前c(Na2CO3)
),则混合前c(Na2CO3)____ c(NaHCO3)(填写“<”“>”“=”)。
 S3N4(s)+6CO(g)-Q(Q>0)。完成下列填空:
S3N4(s)+6CO(g)-Q(Q>0)。完成下列填空:(1)上述反应所涉及的元素,原子半径由小到大的顺序是
(2)比较碳、氮两种元素的非金属性强弱,可以通过化学反应
(3)上述反应混合物中极性分子是
(4)Na2CO3又称纯碱,用电离平衡原理说明Na2CO3溶液呈碱性的原因
 )=c(HCO
)=c(HCO ),则混合前c(Na2CO3)
),则混合前c(Na2CO3)
您最近一年使用:0次
解题方法
2 . 将氟气通入氢氧化钠溶液中,可得OF2。OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2的中文名称是_______ ,OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比, OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2的中文名称是
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比, OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
3 . 二氧化碳开关型溶剂是指在通入和排出二氧化碳后,其溶液性质能发生可逆变化的溶剂,目前是一个研究热点,下式表示的就是该类溶剂的一个例子,属于胺眯(胍)混合体系(-R为烃基):

请回答下列问题;
(1)在通入或者排出二氧化碳时,该溶剂的极性和粘度是否有变化_________ ?说明理由___________ 。
(2)举 一个例子来说明该溶剂的用途(例子中可以不指明具体的物质)______________________ 。

请回答下列问题;
(1)在通入或者排出二氧化碳时,该溶剂的极性和粘度是否有变化
(2)举 一个例子来说明该溶剂的用途(例子中可以不指明具体的物质)
您最近一年使用:0次
名校
4 . 按要求填空:
地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
分析上表所涉及的分子,填写下列空白。
(1)VSEPR模型为正四面体的分子有(填化学式,下同)__ ;
(2)由极性键构成的非极性分子有__ ;
(3)沸点最高的物质是H2O,1mol水最多可形成__ mol氢键;
(4)CO的结构可表示为O C,与CO结构最相似的分子是
C,与CO结构最相似的分子是__ ;
(5)以上分子有多种含有氧原子,请写出基态氧原子的价层电子轨道表达式__ 。
地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
| 目前空气的成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
| 原始大气的主要成分 | CH4、NH3、CO、CO2等 |
(1)VSEPR模型为正四面体的分子有(填化学式,下同)
(2)由极性键构成的非极性分子有
(3)沸点最高的物质是H2O,1mol水最多可形成
(4)CO的结构可表示为O
 C,与CO结构最相似的分子是
C,与CO结构最相似的分子是(5)以上分子有多种含有氧原子,请写出基态氧原子的价层电子轨道表达式
您最近一年使用:0次
解题方法
5 . 请填写下表:
 | 空间构型 | 杂化方式 | 分子类型(极性或非极性) |
| 二氧化硫 | |||
| 氨气 | |||
| 三氧化硫 |
您最近一年使用:0次
解题方法
6 . 在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是__________________ ;
(2)实验测得:μ(PF3)=1.03、μ(BF3)=0。由此可知,PF3分子构型是___________________ ,BF3分子构型是 __________________ 。
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,A:棕黄色者μ>0,B:淡黄色者μ=0。在水中溶解度较大的是______________________ (填序号)。
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是
(2)实验测得:μ(PF3)=1.03、μ(BF3)=0。由此可知,PF3分子构型是
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,A:棕黄色者μ>0,B:淡黄色者μ=0。在水中溶解度较大的是
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
7 . 下列说法正确的是________ 。
①CO2、H2S都属于含极性键的非极性分子
②S2Cl2(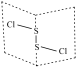 )为含有极性键和非极性键的非极性分子
)为含有极性键和非极性键的非极性分子
③SF6(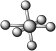 )是由极性键构成的非极性分子
)是由极性键构成的非极性分子
④SO2和NH3均易溶于水,原因之一是它们都是极性分子
⑤CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心
⑥卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大
⑦H2O比H2S稳定是因为水分子间存在氢键
⑧极性分子中可能含有非极性键
⑨HClO2、H2SeO3、H3BO3、HMnO4四种含氧酸中酸性最强的是H3BO3
⑩BF3和NH3化学键的类型和分子的极性(极性或非极性)皆相同
⑪H2O的沸点比HF的沸点高,是由于水中氢键键能大
⑫邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
①CO2、H2S都属于含极性键的非极性分子
②S2Cl2(
 )为含有极性键和非极性键的非极性分子
)为含有极性键和非极性键的非极性分子③SF6(
 )是由极性键构成的非极性分子
)是由极性键构成的非极性分子④SO2和NH3均易溶于水,原因之一是它们都是极性分子
⑤CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心
⑥卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大
⑦H2O比H2S稳定是因为水分子间存在氢键
⑧极性分子中可能含有非极性键
⑨HClO2、H2SeO3、H3BO3、HMnO4四种含氧酸中酸性最强的是H3BO3
⑩BF3和NH3化学键的类型和分子的极性(极性或非极性)皆相同
⑪H2O的沸点比HF的沸点高,是由于水中氢键键能大
⑫邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
您最近一年使用:0次
名校
解题方法
8 . 工业制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+ NaHCO3↓。完成下列填空:
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是_____ ,第二周期原子半径由大到小的是______ 。
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是______ ,该分子为_____ ( 选填“极性”、“非极性”)分子。
(3)写出上述元素中有三个未成对电子的原子核外电子排布式_____ ,下列关于该元素和氧元素之间非金属性大小判断依据正确的是____ (填编号)
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围______ 个NH3通过氢键相结合。
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是_____________ 。
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是
(3)写出上述元素中有三个未成对电子的原子核外电子排布式
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是
您最近一年使用:0次
9 . 碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
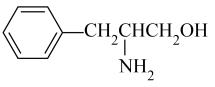
(1)某有机物的结构简式如图。该有机物分子是___ (填“极性”或“非极性”)分子,该有机物分子中电负性最大的原子为___ 。
(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是__ 。
(1)某有机物的结构简式如图。该有机物分子是

(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
您最近一年使用:0次
解题方法
10 . 硒是动物和人体所必需的微量元素之一,在周期表中信息如图所示。完成下列填空:

(1)Se元素在周期表中的位置为___ 。表中78.96的意义为__ 。Se原子最外层电子排布的轨道表示式为___ 。
(2)从原子结构角度解释硫的非金属性大于硒___ 。
(3)硒化氢(H2Se)是一种有恶臭味的有毒气体,是一种___ (选填“极性、或非极性”)分子,其空间结构为___ 型。
(4)工业上常用浓H2SO4焙烧CuSe的方法提取硒,反应产生SO2、SeO2的混合气体,写出反应的化学方程式___ 。理论上该反应每转移1mol电子,可得到SeO2的质量为___ g,得到SO2在标准状况下的体积为___ L。

(1)Se元素在周期表中的位置为
(2)从原子结构角度解释硫的非金属性大于硒
(3)硒化氢(H2Se)是一种有恶臭味的有毒气体,是一种
(4)工业上常用浓H2SO4焙烧CuSe的方法提取硒,反应产生SO2、SeO2的混合气体,写出反应的化学方程式
您最近一年使用:0次



