名校
1 . X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两对成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物。W是第三周期中原子半径最小的元素,N的核电荷数是W与Z的核电荷数之和。NW3能与Z,Q的氢化物形成六配位的配合物,其中两种配体的个数比为2:1,三个W离子位于外界。请回答下列问题:
(1)X、Z、N的元素符号为___________ ,___________ ,___________ 。
(2)比较Y、Z、Q的电负性大小___________ 。
(3)X2Q与ZX3分别为___________ 、___________ (填“极性分子”或“非极性分子”)。
(4)Z、W的最高价含氧酸的酸根的空间构型分别为___________ 、___________ 。
(5)N的价电子排布式___________ ,NW3与Z,Q的氢化物形成六配位的配合物化学式为___________ 。
(1)X、Z、N的元素符号为
(2)比较Y、Z、Q的电负性大小
(3)X2Q与ZX3分别为
(4)Z、W的最高价含氧酸的酸根的空间构型分别为
(5)N的价电子排布式
您最近一年使用:0次
名校
2 . 某纯碱工业的生产流程图如下

(1)该过程是___________ 由提出的(选填“索尔维”或“侯德榜”),写出Z物质的电子式___________
(2)①将原理中涉及到的第二周期的原子的半径按由大到小的顺序排列___________
②例举一个事实证明N的非金属性大于C___________
(3)先吸氨,后碳酸化的根本原因在于___________
a. 和
和 的极性不同
的极性不同
b. 和
和 的沸点不同
的沸点不同
c. 和
和 溶于水后,溶液的酸碱性不同
溶于水后,溶液的酸碱性不同
(4)析出Z之前通 的目的是
的目的是___________
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的 和
和 等气体。铜液吸收
等气体。铜液吸收 的反应是放热反应,其反应方程式为:
的反应是放热反应,其反应方程式为:
则铜液吸收CO的条件___________ (选填编号,下同),铜液再生条件___________
a.高压 b.低压 c.高温 d.低温

(1)该过程是
(2)①将原理中涉及到的第二周期的原子的半径按由大到小的顺序排列
②例举一个事实证明N的非金属性大于C
(3)先吸氨,后碳酸化的根本原因在于
a.
 和
和 的极性不同
的极性不同b.
 和
和 的沸点不同
的沸点不同c.
 和
和 溶于水后,溶液的酸碱性不同
溶于水后,溶液的酸碱性不同(4)析出Z之前通
 的目的是
的目的是(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的
 和
和 等气体。铜液吸收
等气体。铜液吸收 的反应是放热反应,其反应方程式为:
的反应是放热反应,其反应方程式为:
则铜液吸收CO的条件
a.高压 b.低压 c.高温 d.低温
您最近一年使用:0次
2021-10-08更新
|
232次组卷
|
2卷引用:上海市上海交通大学附属中学2021届高三期中考试化学试题
名校
解题方法
3 . 已知A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A的一种核素中子数是质子数的2倍;B含有3个能级,且每个能级所含的电子数相同;D原子基态核外电子运动状态共8种;E为VIII族元素,基态E原子中有4个未成对电子且全在同一能级;E、F原子序数相差3。
(1)写出阳离子E2+的核外电子排布式_______ 。
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是_______ 。(用化学式书写)
(3)由A、B、C、D构成的物质(ADBC)的结构式是_______ ,其中B原子的杂化方式是_______ ,根据等电子体原理,可推测BCD-离子的空间构型是_______ 。
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为___ 。
(5)B、C与A可以形成多种分子,有关说法不正确的是_______ 。
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。
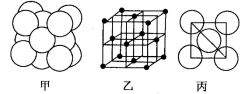
若F原子半径为acm,则F单质晶体的密度为_______ g·cm-3(只列出计算式,阿伏加德罗常数的值为NA)。
(1)写出阳离子E2+的核外电子排布式
(2)B、C、D简单气态氢化物的稳定性由小到大的顺序是
(3)由A、B、C、D构成的物质(ADBC)的结构式是
(4)E元素与D元素形成的ED晶体与NaCl晶体晶胞结构相似,则ED晶体中E离子的配位数为
(5)B、C与A可以形成多种分子,有关说法不正确的是
①B2A2分子中σ键与π键的个数比为3︰2
②CA3和BA4的VSEPR构型相同
③C2A4分子、CA3分子都可以做配体与某些金属离子形成配位键
④BA4是由非极性键构成的非极性分子
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞结构如图乙所示,原子之间相互位置关系的平面图如丙所示。

若F原子半径为acm,则F单质晶体的密度为
您最近一年使用:0次
2021-08-03更新
|
231次组卷
|
2卷引用:黑龙江省大庆市2020届高三第一次质量检测化学试题
解题方法
4 . 已知A、B、C、D、E、F是前四周期的核电荷数依次增大的主族元素,A的最外层电子数是其电子层数的2倍,C、D同一主族,D元素原子M层有两对成对电子,E在前四周期主族元素中原子半径最大,F的基态原子中有4个未成对电子。
(1)基态F2+的电子排布式是______ 。
(2)B、C、D的第一电离能由大到小的顺序是______ (填字母对应的元素符号)。
(3) 离子的空间构型为
离子的空间构型为_______ 。
(4)某F的配合物化学式是[F(H2O)5Cl]Cl2·H2O,与中心F3+的形成配位键的原子或离子是_____ 。
(5)F(AC)5常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。每个AC分子与F原子间均有1个配位键。
①1molF(AC)5中所含σ键的数目为______ 。
②1molF(AC)5分子的结构可能为下图中的______ (填“甲”或“乙"),理由是______ 。

(6)由A、B、E、F元素形成的一种蓝色晶体,其晶体结构示意图如图两所示(图中E的离子未画出)。该蓝色晶体的化学式为____ 。
(1)基态F2+的电子排布式是
(2)B、C、D的第一电离能由大到小的顺序是
(3)
 离子的空间构型为
离子的空间构型为(4)某F的配合物化学式是[F(H2O)5Cl]Cl2·H2O,与中心F3+的形成配位键的原子或离子是
(5)F(AC)5常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。每个AC分子与F原子间均有1个配位键。
①1molF(AC)5中所含σ键的数目为
②1molF(AC)5分子的结构可能为下图中的

(6)由A、B、E、F元素形成的一种蓝色晶体,其晶体结构示意图如图两所示(图中E的离子未画出)。该蓝色晶体的化学式为
您最近一年使用:0次
5 . N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)与 互为等电子体的微粒有
互为等电子体的微粒有_______ (任写1种)。
(2)H2O的沸点比H2S高的原因是______ ;SO2属于_____ (填“极性”或“非极性”)分子,1molCOCl2含有的π键为_____ mol。
(3)Cu与Cl形成化合物的晶胞如图所示。
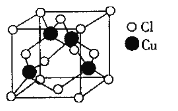
该晶体的化学式为_____ 。已知该晶体中Cu原子和Cl原子之间的最短距离为a nm,且恰好为体对角线的 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为_____ (只写计算式)g/cm3。
(1)与
 互为等电子体的微粒有
互为等电子体的微粒有(2)H2O的沸点比H2S高的原因是
(3)Cu与Cl形成化合物的晶胞如图所示。

该晶体的化学式为
 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
6 . 氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1) 是一种过渡元素硼氢化物储氢材料。
是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为_______ 。
② 的空间构型是
的空间构型是_______ (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢
2NH3实现储氢和输氢 下列说法正确的是
下列说法正确的是_______
 分子中N原子采用
分子中N原子采用 杂化
杂化
 相同压强时,
相同压强时, 沸点比
沸点比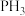 高
高
 离子中,N原子是配位原子
离子中,N原子是配位原子
 的电子式为
的电子式为
(3) 年,Yoon等人发现Ca与C60(分子结构如图)生成的
年,Yoon等人发现Ca与C60(分子结构如图)生成的 能大量吸附
能大量吸附 分子。
分子。

①C60晶体易溶于苯、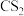 ,C60是
,C60是_______ 分子(填“极性”或“非极性”)
②1molC60分子中,含有 键数目为
键数目为_______ 。
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为ag∙cm3,则晶胞的体积为_______ cm3[a、NA表示(NA表示阿伏加德罗常数的值)]。

(1)
 是一种过渡元素硼氢化物储氢材料。
是一种过渡元素硼氢化物储氢材料。①Ti2+基态的电子排布式可表示为
②
 的空间构型是
的空间构型是(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2
 2NH3实现储氢和输氢
2NH3实现储氢和输氢 下列说法正确的是
下列说法正确的是 分子中N原子采用
分子中N原子采用 杂化
杂化 相同压强时,
相同压强时, 沸点比
沸点比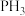 高
高 离子中,N原子是配位原子
离子中,N原子是配位原子 的电子式为
的电子式为
(3)
 年,Yoon等人发现Ca与C60(分子结构如图)生成的
年,Yoon等人发现Ca与C60(分子结构如图)生成的 能大量吸附
能大量吸附 分子。
分子。
①C60晶体易溶于苯、
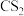 ,C60是
,C60是②1molC60分子中,含有
 键数目为
键数目为(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为ag∙cm3,则晶胞的体积为

您最近一年使用:0次
名校
7 . 已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4.试回答:
(1)该化合物中是否存在氢键(填“是”或“否”)___________ ,分子为___________ (填“极性分子”或“非极性分子”)。
(2)该化合物在常温下为液体,该液体微粒间的作用力是___________ 。
(3)该化合物的沸点与SiCl4比较:___________ (填化学式)的高,原因是___________ 。
(1)该化合物中是否存在氢键(填“是”或“否”)
(2)该化合物在常温下为液体,该液体微粒间的作用力是
(3)该化合物的沸点与SiCl4比较:
您最近一年使用:0次
名校
解题方法
8 . 现有X、Y、Z、W、M、N六种短周期主族元素,其原子序数依次增大。基态X原子有2个未成对的电子,Y与M同主族,基态Y原子的s电子总数与p电子总数相等,Z在短周期中原子半径最大,W 与N可形成共价化合物W2N6。
(1)基态X原子核外电子占据最高能层的符号____ ;基态Y原子的核外电子排布图____ ;元素W在周期表中的位置____ 。
(2)写出由Y、Z两种元素形成的淡黄色固体的电子式_____ 。
(3)在M常见的两种氧化物对应的水化物中,酸性更强的是___ (填化学式),理由_____ 。
(4)在相同条件下,MY2在水中溶解度比XY2在水中溶解度大,从结构角度解释原因:_____ 。
(5)实验室常用N的氢化物的浓溶液制N单质,其离子反应方程式:______ ;向KI溶液中通入适量的N单质后,再滴加一定量的CCl4,振荡静置后,观察到的现象是____
(1)基态X原子核外电子占据最高能层的符号
(2)写出由Y、Z两种元素形成的淡黄色固体的电子式
(3)在M常见的两种氧化物对应的水化物中,酸性更强的是
(4)在相同条件下,MY2在水中溶解度比XY2在水中溶解度大,从结构角度解释原因:
(5)实验室常用N的氢化物的浓溶液制N单质,其离子反应方程式:
您最近一年使用:0次
9 . A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外M层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A_________ ;B_________ ;C__________ ;
(2)BC2是由______ 键组成的________ (填“极性”或“非极性”)分子。
(3)C原子的外围电子排布式___________ ;
(4)画出B的轨道排布式___________
(1)它们的元素符号分别为:A
(2)BC2是由
(3)C原子的外围电子排布式
(4)画出B的轨道排布式
您最近一年使用:0次
名校
解题方法
10 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
Ⅰ.利用反应:6NO2+8NH3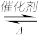 7N2+12H2O处理
7N2+12H2O处理
Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)
Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)硫离子的电子结构示意图为_____ ,氨气分子的电子式为______ ,氨气分子属于______ 分子(填“极性”或者“非极性”)。
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为_____________ ,能证明其递变规律的事实是_______ 。
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=______________ 。
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是______ 。
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
Ⅰ.利用反应:6NO2+8NH3
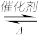 7N2+12H2O处理
7N2+12H2O处理Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)(1)硫离子的电子结构示意图为
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
2020-09-20更新
|
609次组卷
|
4卷引用:湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题
湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题



