名校
1 . 下列描述中正确的是
| A.氨气极易溶于水、邻羟基苯甲醛的沸点低于对羟基苯甲醛都能用氢键来解释 |
| B.物质只有发生化学变化时才会有化学键的断裂 |
| C.甘油中含有1个手性碳原子 |
D.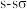 键与 键与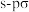 键的电子云对称性不同 键的电子云对称性不同 |
您最近一年使用:0次
2024-02-19更新
|
179次组卷
|
2卷引用:河南省济源一中2022-2023学年高二下学期5月月考化学试题
名校
解题方法
2 . 对下列事实的解释不正确 的是
| 选项 | 事实 | 解释 |
| A | 稳定性:HF>HI | HF分子间存在氢键,HI分子间不存在氢键 |
| B | 键角:NH >H2O >H2O | 中心原子均采取sp3杂化,孤电子对有较大的斥力 |
| C | 熔点:石英>干冰 | 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强 |
| D | 酸性:CF3COOH>CCl3COOH | F的电负性大于Cl,F-C的极性大于Cl-C,使F3C-的极性大于Cl3C-的极性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-01更新
|
1839次组卷
|
13卷引用:河南省济源一中2022-2023学年高二下学期5月月考化学试题
河南省济源一中2022-2023学年高二下学期5月月考化学试题北京市东城区2023届一模考试化学试题天津市第二十中学2022-2023学年高二下学期期中考试化学试题河南省实验中学2022-2023学年高二下学期期中考试化学试题天津市滨海新区2023届普通高考第三次模拟检测化学试题安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题天津经济技术开发区第一中学2023-2024学年高三上学期开学检测化学试题北京市第二十中学2023-2024学年高三上学期10月月考化学试题海南省海口市第一中学2023-2024学年高二上学期第一次月考化学试题北京市铁路第二中学2023-2024学年高三上学期期中考试化学试题北京市第八中学2023-2024学年高三上学期12月月考化学试题(已下线)热点07 分子晶体与共价晶体浙江省杭州地区(含周边)重点高中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
3 . 元素H、C、N可组成多种杂环化合物,例如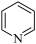 (吡啶)、
(吡啶)、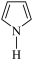 (吡咯),下列说法错误的是
(吡咯),下列说法错误的是
 (吡啶)、
(吡啶)、 (吡咯),下列说法错误的是
(吡咯),下列说法错误的是A.电负性: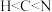 | B. 中, 中, 为 为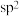 杂化 杂化 |
C. 、 、 都难溶于水 都难溶于水 | D. 、 、 都含有π键 都含有π键 |
您最近一年使用:0次
2022-06-20更新
|
197次组卷
|
4卷引用:河南省济源高级中学2022-2023学年高二下学期4月月考 化学试卷
名校
4 . 第24届冬奥会在北京、张家口两地举办。国家速滑馆“冰丝带”里屡破奥运会纪录,该冰场是冬奥史上“最快冰面”。冰层表面的结构如图所示。下列有关说法错误的是
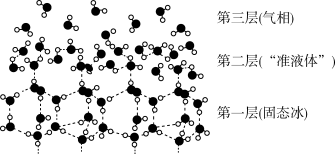

A.冰熔化成水的过程中,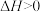 , ,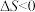 |
| B.第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小 |
| C.第二层“准液体”中,水分子间形成氢键的数目比固态冰中少 |
| D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性水分子”,使冰面变滑 |
您最近一年使用:0次
2022-03-18更新
|
698次组卷
|
5卷引用:河南省济源高级中学2022-2023学年高二下学期4月月考 化学试卷
5 . 2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二酶、LiPF6、LiAsF6,和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Li、F、P、As四种元素的第一电离能由大到小的顺序为___ 。
(2)乙二醇(HCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点:丙醇97.2℃,乙二醇197.3%℃,原因是___ 。
(3)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
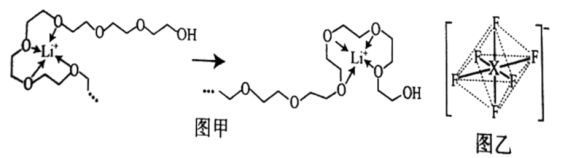
①聚乙二醇分子中,碳、氧的杂化类型分别是___ 、___ 。
②从化学键角度看,Li+迁移过程发生___ (填“物理变化”或“化学变化”)。
③PF 中P的配位数为
中P的配位数为___ 。
④相同条件,Li+在LiAsF6中迁移较快,原因是___ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl•3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl•3H2O晶体的密度为___ g·cm-3(列出计算表达式)。

(1)Li、F、P、As四种元素的第一电离能由大到小的顺序为
(2)乙二醇(HCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点:丙醇97.2℃,乙二醇197.3%℃,原因是
(3)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①聚乙二醇分子中,碳、氧的杂化类型分别是
②从化学键角度看,Li+迁移过程发生
③PF
 中P的配位数为
中P的配位数为④相同条件,Li+在LiAsF6中迁移较快,原因是
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为

您最近一年使用:0次
6 . 铁氮化合物(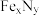 )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某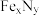 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
(1) 基态核外电子排布方式为
基态核外电子排布方式为_______ 。
(2)Fe3+的化学性质比Fe2+稳定,其原因是_______ 。
(3)丙酮( )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是_______ ,1mol丙酮分子含有 键的数目为
键的数目为_______ 。
(4)C、H、O三种元素的电负性由小到大的顺序为_______ 。
(5)乙醇的沸点高于丙酮,这是因为_______ 。
(6)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_______ 。
(7)比较离子半径:F-_______ O2-(填“大于”等于”或“小于”)。
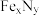 )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某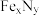 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。(1)
 基态核外电子排布方式为
基态核外电子排布方式为(2)Fe3+的化学性质比Fe2+稳定,其原因是
(3)丙酮(
 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是 键的数目为
键的数目为(4)C、H、O三种元素的电负性由小到大的顺序为
(5)乙醇的沸点高于丙酮,这是因为
(6)元素As与N同族。预测As的氢化物分子的立体结构为
(7)比较离子半径:F-
您最近一年使用:0次



