名校
1 . 冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图,下列有关冰晶胞说法正确的是


| A.冰晶胞内水分子间以共价键结合 |
| B.每个冰晶胞平均含有4个水分子 |
| C.水分子间的氢键具有方向性和饱和性,也是σ键的一种 |
| D.实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏 |
您最近一年使用:0次
2017-05-10更新
|
588次组卷
|
3卷引用:辽宁省鞍山市第一中学2016-2017学年高二下学期期中考试化学试题1
名校
解题方法
2 . 短周期元素X、Y、W的原子序数依次增大,元素X的一种单质有杀菌消毒的作用,Y与X的某种化合物A可以作潜水艇的供氧剂。 W质子数为偶数,室温下W单质为黄色固体。生活中常见元素M的一种氧化物有磁性,回答下列问题:
(1)W元素位于周期表中的第________ 周期、_________ 族。
(2)写出化合物A的电子式____________ 。用电子式表示W元素气态氢化物的形成过程____________ 。
(3)X的简单氢化物与M的单质在高温下反应的化学方程式为__________
(4)X的氢化物沸点高于W的氢化物沸点,原因是___________
(1)W元素位于周期表中的第
(2)写出化合物A的电子式
(3)X的简单氢化物与M的单质在高温下反应的化学方程式为
(4)X的氢化物沸点高于W的氢化物沸点,原因是
您最近一年使用:0次
名校
3 . 下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键②共价化合物一定含共价键,也可能含离子键③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物⑤由分子组成的物质中一定存在共价键⑥水很稳定,是因为水分子中存在氢键
①离子化合物一定含离子键,也可能含极性键或非极性键②共价化合物一定含共价键,也可能含离子键③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物⑤由分子组成的物质中一定存在共价键⑥水很稳定,是因为水分子中存在氢键
| A.①③ | B.②④⑥ | C.②③④ | D.①③⑥ |
您最近一年使用:0次
名校
4 . (1)写出表示含有8个质子,10个中子的原子的化学符号:____________ 。
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________ 。
(3)某元素的一种核素的质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量为________ mol。
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为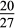 ,已知该元素的原子核内质子数和中子数相等,则该元素的名称为
,已知该元素的原子核内质子数和中子数相等,则该元素的名称为________ 。
(5)下列物质中:①氩单质 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥金刚石 ⑦H2SO4 ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是_______ (填序号);
属于离子化合物,但含有极性共价键的是______ (填序号)。
(6)如图所示每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是______
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=
(3)某元素的一种核素的质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量为
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为
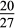 ,已知该元素的原子核内质子数和中子数相等,则该元素的名称为
,已知该元素的原子核内质子数和中子数相等,则该元素的名称为(5)下列物质中:①氩单质 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥金刚石 ⑦H2SO4 ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是
属于离子化合物,但含有极性共价键的是
(6)如图所示每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
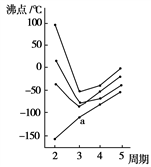
您最近一年使用:0次
名校
5 . 下列说法中错误的是
| A.卤化氢中,HF的沸点最高,是由于HF分子间存在氢键 |
| B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 |
| C.H2O的沸点比HF的沸点高,是由于水中氢键键能大 |
| D.氨气极易溶于水与氨气分子和水分子间形成氢键有关 |
您最近一年使用:0次
2017-02-17更新
|
612次组卷
|
16卷引用:辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题
辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题2016-2017学年河北省张家口一中高二12月月考化学卷陕西省黄陵中学2016-2017学年高二(重点班)下学期第四学月考试化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质(已下线)【段考模拟】高二化学下学期第一次月考(3月)原创B卷安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 课时2 分子间的作用力(已下线)2.3.2 氢键 溶解性 分子的手性-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题河南省驻马店市环际大联考2021-2022学年高二下学期期中考试化学试题云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题(已下线)第五章 物质结构与性质元素周期律 第30练 配合物 分子间作用力超分子河南省郑州市十校2022-2023学年高二下学期期中联考化学试题广西壮族自治区钦州市第四中学2022-2023学年高二下学期3月月考化学试卷(已下线)第5讲 分子结构与性质福建省福州外国语学校2023-2024学年高二下学期4月期中化学试题
解题方法
6 . 原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1)F原子基态的外围核外电子排布式为___________ ;
(2)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为___________ ;
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为___________ ;
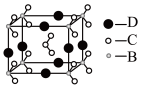
(4)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________ ;
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2═CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。下列说法正确的是___________;
(6)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4该配合物中心离子的配体为___________ ,其中提供空轨道的是___________ (填微粒符号)。
(1)F原子基态的外围核外电子排布式为
(2)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为
(4)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为

(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2═CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。下列说法正确的是___________;
| A.N2O为直线型分子 |
| B.C、N、O的第一电离能依次增大 |
| C.CH2═CH一CHO分子中碳原子均采用sp2杂化 |
| D.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
您最近一年使用:0次
名校
7 . 下列对一些实验事实的解释正确的是( )
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
| C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
| D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
368次组卷
|
12卷引用:2015-2016学年四川成都外国语学校高一下期末理科化学卷
2015-2016学年四川成都外国语学校高一下期末理科化学卷2015-2016学年广东省肇庆市高二下期末化学试卷江苏省江阴市四校2016-2017学年高二下学期期中考试化学试题甘肃省兰州市第一中学2016-2017学年高二下学期期中考试化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题江苏省泰州中学2017-2018学年高二4月月考化学试题【全国百强校】四川省绵阳南山中学2018-2019学年高二下学期入学考试化学试题福建省龙海市程溪中学2018-2019学年高二下学期期中考试化学试题四川省雅安中学2019-2020学年高二上学期期中考试化学试题(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷
解题方法
8 . 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是__________ 。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________________ 。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为________ (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:______________ 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为________________ 。
(1)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为
②写出一种与YZ42-互为等电子体的分子的化学式:
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为
您最近一年使用:0次
解题方法
9 . 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满。
回答下列问题:
(1)W+的价电子排布式为_____________________ 。
(2)Y2X2分子中Y原子轨道的杂化类型为____ ,1mol Y2X2含有σ键的数目为___ 。
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是______________ 。
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是__ 。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是______ ,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为_______ 。在晶胞中最近的2个原子距离是apm,晶胞的密度是_____________ g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
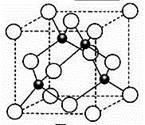
回答下列问题:
(1)W+的价电子排布式为
(2)Y2X2分子中Y原子轨道的杂化类型为
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

您最近一年使用:0次
名校
10 . “类推”是一种重要的学习方法,但有时也可能会产生错误的结论,下列类推结论中正确的是
| A.第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 |
| B.ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是AsH3>PH3>NH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
| D.干冰(CO2)是分子晶体;则SiO2也是分子晶体 |
您最近一年使用:0次
2016-12-09更新
|
210次组卷
|
5卷引用:2015-2016学年辽宁省大连市瓦房店高中高二下期末化学试卷



