名校
解题方法
1 . 下列说法不正确的是
①N2H4分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量的增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦由于非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI
①N2H4分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量的增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦由于非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI
| A.②⑤⑥⑦ | B.①③⑤ | C.②④⑤ | D.③⑤⑦ |
您最近一年使用:0次
2022-12-10更新
|
206次组卷
|
21卷引用:辽宁省实验中学2017-2018学年高一下学期期末考试化学试题
辽宁省实验中学2017-2018学年高一下学期期末考试化学试题辽宁省瓦房店市高级中学2019-2020学年高一下学期期末考试化学试题黑龙江省大庆第一中学2019-2020学年高一下学期期末考试化学试题辽宁省沈阳市辽宁省实验中学2020届高三上学期期中考试化学试题成都外国语学校2017-2018学年高一下学期期中考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题湖北省黄石市第二中学2019--2020学年高二下学期5月考试化学试题河南省新乡市辉县市第二高级中学2019-2020学年高一下学期第一次月考化学试题(B部)河南省新乡市辉县市第二高级中学2019-2020学年高一下学期第一次月考试化学试题(A部)湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一下学期期中考试化学试题(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测湖南省娄底市双峰县第一中学2020-2021学年高二上学期9月入学考试化学试题四川省威远中学2020-2021学年高二上学期第一次月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷黑龙江牡丹江农管局密山农垦子弟学校2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一下学期线下开学考试化学试题陕西省西安市长安区第一中学2021-2022学年高一下学期第一次月考化学试题黑龙江省大庆市实验中学实验二部2023-2024学年高一下学期开学考试化学试题河北省石家庄市第二中学2023-2024学年高一下学期学情调研化学试题
解题方法
2 . 四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物阴阳离子个数比为1:1,下列说法正确的是
| A.W的氢化物比Y的氢化物的沸点高 |
| B.气态氢化物的稳定性Y>Z |
| C.W、X、Y三种元素组成的化合物一定不与氧气反应 |
| D.化合物YWZ2遇水产生的气体,可能使石蕊溶液先变红后褪色 |
您最近一年使用:0次
2021-02-28更新
|
645次组卷
|
3卷引用:辽宁沈阳市第二十八中学2020--2021学年高一上学期期末考试化学试题
辽宁沈阳市第二十八中学2020--2021学年高一上学期期末考试化学试题(已下线)第1章 物质结构 元素周期律(基础过关卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)甘肃省天水市第五中学2020—2021学年高一下学期第一次月考化学试题
3 . a、b、c、d、e五种短周期主族元素,原子半径与原子序数的关系如图,下列说法错误的是
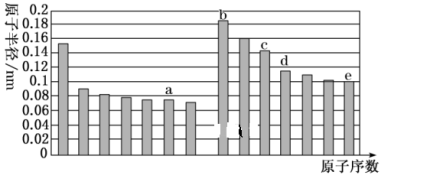

| A.a、e两种元素的气态氢化物的沸点相比,后者较高 |
| B.c、e两种元素的离子半径相比,前者较小 |
| C.由a与b两种元素组成的化合物阴阳离子个数比一定为1:2 |
| D.a、b、c组成的化合物水溶液通入SO2有沉淀生成 |
您最近一年使用:0次
名校
4 . 离子液体作为一类新型介质可实现 CO2 在温和条件下的高效捕获,某种离子液体 M捕获 CO2 机理如图所示。下列说法错误的是


| A.离子液体M 较容易吸收水分 |
| B.该捕获过程发生了氧化反应 |
| C.一个 CO2 分子中存在两个键和两个π键 |
| D.离子液体M 的粘度随着 R 链的增长而增大 |
您最近一年使用:0次
2020-12-28更新
|
151次组卷
|
2卷引用:辽宁省凌源市第二高级中学2021届高三上学期教学质量检测化学试题
10-11高二下·湖北武汉·期中
名校
解题方法
5 . 下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
您最近一年使用:0次
2020-09-11更新
|
619次组卷
|
33卷引用:辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题
辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题(已下线)2011-2012学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2011-2012学年海南省海南中学高二下学期期末理科化学试卷(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷宁夏银川市第一中学2016-2017学年高二下学期期末考试化学试题甘肃省嘉峪关市一中2017-2018学年高二上学期期末考试化学(理)试题宁夏银川一中2018-2019学年高二下学期期末考试化学试题(已下线)2010-2011学年湖北省武汉市三角路中学高二下学期期中考试化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2013-2014广西桂林十八中高二下学期开学考试化学试卷(已下线)2014届江苏省启东中学第二学期期中考试高二化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷2016-2017学年四川省成都市石室佳兴外国语学校高二下学期第一次月考化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题四川省乐山沫若中学2017-2018学年高二上学期第一次月考化学试题安徽省安庆市五校联盟2017-2018学年高二上学期期中联考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期4月月考化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题陕西省宝鸡中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题内蒙古自治区包头市北方重工业集团有限公司第三中学2019-2020学年高二下学期期中考试化学试题(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练山西省朔州市怀仁县大地学校2019-2020学年高二下学期第二次月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题山西省吕梁市2023-2024学年高二上学期1月期末化学试题(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题(已下线)2.3.2 氢键 溶解性 分子的手性-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)河南省渑池高级中学2021-2022学年高二11月月考化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题
名校
解题方法
6 . 下列有关性质的比较中,正确的是
| A.键的极性:N-H<O-H<F-H |
| B.第一电离能:Na<Mg<Al |
| C.硬度:白磷>冰>二氧化硅 |
D.熔点: > >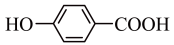 |
您最近一年使用:0次
2020-09-07更新
|
1027次组卷
|
7卷引用:辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷
辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷(已下线)第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)吉林省延边第二中学2020-2021学年高二下学期期中考试化学试题(已下线)第2章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)北京市房山区2021-2022学年高二下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测广东省广州市第十六中学2022-2023学年高二下学期5月月考化学试题
7 . 某一化合物分子式为AB2,A属于第VIA族元素,B属于第VIIA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98。下列推断不正确的是
| A.AB2分子的空间构型为V形 |
| B.A-B键为极性键,AB2分子为非极性分子 |
| C.AB2与水相比,AB2的熔沸点比水的熔沸点低 |
| D.A原子的杂化方式是sp3杂化 |
您最近一年使用:0次
解题方法
8 . 下列描述正确的是
| A.CS2为V形极性分子 |
| B.C2H2分子中σ键与π键的数目比为1:1 |
| C.当中心离子的配位数为6时,配离子常呈八面体结构 |
| D.水加热到很高温度都难分解是因水分子间存在氢键 |
您最近一年使用:0次
9 . 黑色金属是指铁、铬、锰及其合金,在生产生活中有广泛的用途。请回答下列问题:
(1)基态铬原子的核外电子排布式____________ ,能量最高的原子轨道有____________ 种空间伸展方向。
(2)[Cr(H2O)3(NH3)3]3+中,与Cr3+形成配位键的原子是____________ ,NH3的VSEPR模型为____________ ,H2O中氧原子的杂化类型为____________ 。
(3)H2O的稳定性____________ (填大于或小于)NH3的稳定性,请用共价键知识解释原因:____________ 。
(4)元素铁和锰的逐级电离能如图所示,

元素X是____________ (填元素符号),判断理由是____________ 。
(5)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ和π键个数比为____________ ,C、O元素的第一电离能是C____________ O。(填“>”“<”或“=”)
(6)Fe3+可用SCN-检验,类卤素(SCN)2对应的酸有两种,分别为硫氰酸(H—S—C N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是
N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是____________ (填名称),原因是____________ 。
(1)基态铬原子的核外电子排布式
(2)[Cr(H2O)3(NH3)3]3+中,与Cr3+形成配位键的原子是
(3)H2O的稳定性
(4)元素铁和锰的逐级电离能如图所示,

元素X是
(5)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ和π键个数比为
(6)Fe3+可用SCN-检验,类卤素(SCN)2对应的酸有两种,分别为硫氰酸(H—S—C
 N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是
N))和异硫氰酸(H—N=C=S),这两种酸中沸点较高的是
您最近一年使用:0次
解题方法
10 . 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素,E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为________ (用元素符号表示)。
(3)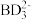 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为________ 杂化;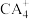 的空间构型为
的空间构型为________ 。
(4)化合物B2A4中含有σ键与π键的个数比为________ 。
(5)比较D、E元素最简单氢化物的沸点高低________ (用化学式表示),理由是________ (用文字表达)。
(6)C、F两元素形成的某化合物的晶胞结构如图所示,顶点为C原子,则该化合物的化学式是________ ,C原子的配位数是________ ,若相邻C原子和F原子间的距离为acm,阿伏加 德罗常数为NA,则该晶体的密度为________ g/cm3(用含a、NA的符号表示)。
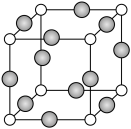
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)
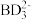 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为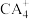 的空间构型为
的空间构型为(4)化合物B2A4中含有σ键与π键的个数比为
(5)比较D、E元素最简单氢化物的沸点高低
(6)C、F两元素形成的某化合物的晶胞结构如图所示,顶点为C原子,则该化合物的化学式是

您最近一年使用:0次



