名校
1 . 某种具有许多优良特性的离子液体如图所示,下列说法中不正确的是


| A.该离子液体不具备与水分子形成氢键的条件 | B.该晶体属于离子晶体 |
C.B原子价电子排布式为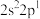 | D.电负性大小顺序为N>C>B |
您最近一年使用:0次
2023-02-10更新
|
317次组卷
|
2卷引用:辽宁省沈阳市第十五中学2022-2023学年高二下学期4月月考化学试题
名校
2 . 下列关于物质的结构或性质及解释均正确的是
选项 | 物质的结构或性质 | 解释 |
A | 键角:H2O>NH3 | 水分子中O上孤电子对数比氨分子中N上的多 |
B | 热稳定性:NH3>PH3 | NH3分子间氢键强于PH3分子间作用力 |
C | 熔点:晶体硅>碳化硅 | Si-Si的键能大于C-Si的键能 |
D | 电子云半径:3s>1s | 3s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-05更新
|
494次组卷
|
4卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二上学期期末考试化学试题
名校
3 . 某农药杀虫剂中含有的成分如图。已知X、Y、Z、N、M为原子序数依次增大的短周期元素,已知Y、Z位于同一个周期,X、N位于同一主族。则下列说法错误的是
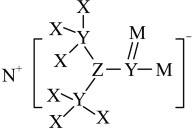
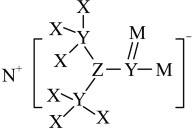
A.电负性大小排序: |
| B.该化合物难溶于水,不能与水形成氢键 |
C.该化合物可与 、 、 等形成配合物 等形成配合物 |
| D.M的最高价氧化物的水化物形成的浓溶液能与M的气态氢化物反应 |
您最近一年使用:0次
2023-01-12更新
|
476次组卷
|
6卷引用:辽宁省葫芦岛市普通高中2022-2023学年高三第一次模拟考试(一模) 化学试题
名校
4 . “类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,错误的是
| 选项 | 事实 | 推测 |
| A |  与冷水较难反应, 与冷水较难反应, 与冷水较易反应 与冷水较易反应 |  (铍)与冷水更难反应 (铍)与冷水更难反应 |
| B |  与 与 形成离子键, 形成离子键, 与 与 形成共价键 形成共价键 |  与 与 形成共价键 形成共价键 |
| C | ⅣA族元素氢化物沸点顺序是 | ⅤA族元素氢化物沸点顺序也是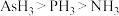 |
| D | 第二周期元素氢化物稳定性顺序是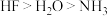 | 则第三周期元素氢化物稳定性顺序也是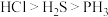 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-09更新
|
373次组卷
|
2卷引用:辽宁省沈阳市第十中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 下列说法正确的是
A.沸点大小: |
B. 很稳定性很强,是因为分子间能形成氢键 很稳定性很强,是因为分子间能形成氢键 |
C.对羟基苯甲醛( )比邻羟基苯甲醛( )比邻羟基苯甲醛( )的沸点低 )的沸点低 |
| D.构成单质分子的微粒之间不一定存在共价键 |
您最近一年使用:0次
6 . 按要求填空:
(1)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(2) 基态核外电子排布式为
基态核外电子排布式为_______ ,基态O原子的价层电子排布图为_______ 。
(3) 的空间结构是
的空间结构是_______ ,其中S原子的杂化轨道类型是_______ 。
(4) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______
(5)某元素 价离子的电子排布式为
价离子的电子排布式为 ,该元素在周期表中的位置
,该元素在周期表中的位置_______
(1)基态K原子中,核外电子占据最高能层的符号是
(2)
 基态核外电子排布式为
基态核外电子排布式为(3)
 的空间结构是
的空间结构是(4)
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(5)某元素
 价离子的电子排布式为
价离子的电子排布式为 ,该元素在周期表中的位置
,该元素在周期表中的位置
您最近一年使用:0次
2023-01-05更新
|
347次组卷
|
2卷引用:辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题
名校
7 . 布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的成修饰: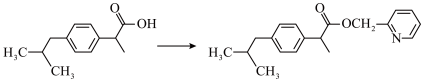 ,以减轻副作用,下列说法正确的是
,以减轻副作用,下列说法正确的是
 ,以减轻副作用,下列说法正确的是
,以减轻副作用,下列说法正确的是| A.该做法使布洛芬水溶性增强 |
| B.布洛芬和成酯修饰产物中均含手性碳原子 |
C. 布洛芬与足量氢气发生反应理论上可消耗 布洛芬与足量氢气发生反应理论上可消耗 |
| D.布洛芬中所有的碳原子可能共平面 |
您最近一年使用:0次
2022-12-14更新
|
655次组卷
|
3卷引用:辽宁省葫芦岛市普通高中2022-2023学年高三第一次模拟考试(一模) 化学试题
解题方法
8 . 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和(指 的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究
的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究 转化为甲醛等其他物质的途径,其中涉及以下两步反应:
转化为甲醛等其他物质的途径,其中涉及以下两步反应:
i、 ;
;
ii、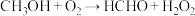 。
。
研究发现,反应i在Co氧化物负载的Mn氧化物纳米粒子催化剂的作用下具有高活性,另外含Mg、Fe、Cu等元素的催化剂在捕捉回收 中也有很高的催化作用。
中也有很高的催化作用。
(1)Mn元素基态原子的价层电子排布式为___________ ,Fe元素在元素周期表中位于第四周期第___________ 族。
(2)Mg元素的第一电离能高于Al元素的,原因是___________ 。
(3)反应ii中,HCHO分子中C原子采用的杂化方式为___________ ;下列关于 的说法错误的是
的说法错误的是___________ (填标号)。
A.含 键B.含
键B.含 键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形
键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形
(4)反应i和反应ii所涉及的4种含氢化合物中,沸点从高到低的顺序为___________ (填化学),原因是___________ 。
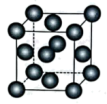
(5)铜单质的晶胞结构如图所示,铜原子位于正方体的顶点和面心。已知铜原子的半径为d,铜单质的摩尔质量为M, 表示阿伏加德罗常数的值。则铜原子的配位数为
表示阿伏加德罗常数的值。则铜原子的配位数为___________ ,铜晶体的密度为___________ (填含M、 、d的表达式)。
、d的表达式)。
 的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究
的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究 转化为甲醛等其他物质的途径,其中涉及以下两步反应:
转化为甲醛等其他物质的途径,其中涉及以下两步反应:i、
 ;
;ii、
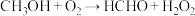 。
。研究发现,反应i在Co氧化物负载的Mn氧化物纳米粒子催化剂的作用下具有高活性,另外含Mg、Fe、Cu等元素的催化剂在捕捉回收
 中也有很高的催化作用。
中也有很高的催化作用。(1)Mn元素基态原子的价层电子排布式为
(2)Mg元素的第一电离能高于Al元素的,原因是
(3)反应ii中,HCHO分子中C原子采用的杂化方式为
 的说法错误的是
的说法错误的是A.含
 键B.含
键B.含 键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形
键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形(4)反应i和反应ii所涉及的4种含氢化合物中,沸点从高到低的顺序为
(5)铜单质的晶胞结构如图所示,铜原子位于正方体的顶点和面心。已知铜原子的半径为d,铜单质的摩尔质量为M,
 表示阿伏加德罗常数的值。则铜原子的配位数为
表示阿伏加德罗常数的值。则铜原子的配位数为 、d的表达式)。
、d的表达式)。
您最近一年使用:0次
解题方法
9 . 配合物在光电传感器、电镀、染料方面有着重要的应用价值,一氧化碳、氨气、酞菁分子是常见形成配合物的三种配位体,请回答下列问题:
(1)一氧化碳和氨气涉及的元素中电负性最大的是_______ (填元素符号)。
(2)邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,熔点较高的是
)都是合成酞菁的原料,熔点较高的是_______ (填化学式),原因为_______ 。
(3) 和
和 可形成配离子
可形成配离子 ,则该配离子的空间结构为
,则该配离子的空间结构为_______ 。
(4) 能与
能与 形成配合物
形成配合物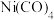 。
。
① 中含有
中含有_______  键;中心原子
键;中心原子 的杂化类型为
的杂化类型为_______ 。
②金属 的原子堆积模型如图,则金属
的原子堆积模型如图,则金属 的晶胞俯视图为
的晶胞俯视图为_______ (填标号),假设 原子的半径是
原子的半径是 ,该晶体的密度是
,该晶体的密度是 ,则
,则 的相对原子质量为
的相对原子质量为_______ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

(1)一氧化碳和氨气涉及的元素中电负性最大的是
(2)邻苯二甲酸酐(
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,熔点较高的是
)都是合成酞菁的原料,熔点较高的是(3)
 和
和 可形成配离子
可形成配离子 ,则该配离子的空间结构为
,则该配离子的空间结构为(4)
 能与
能与 形成配合物
形成配合物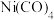 。
。①
 中含有
中含有 键;中心原子
键;中心原子 的杂化类型为
的杂化类型为②金属
 的原子堆积模型如图,则金属
的原子堆积模型如图,则金属 的晶胞俯视图为
的晶胞俯视图为 原子的半径是
原子的半径是 ,该晶体的密度是
,该晶体的密度是 ,则
,则 的相对原子质量为
的相对原子质量为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
10 . 如图为元素周期表的一部分,列出了前四周期10种主族元素在周期表中的位置。
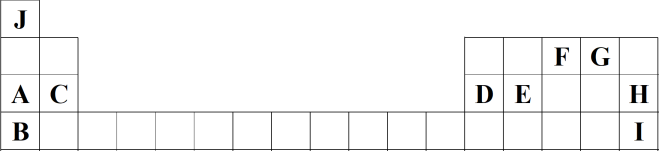
请回答下列问题:
(1)元素E的原子结构示意图为___________ ,I在元素周期表中的位置为___________ ,C与I形成的化合物的电子式为___________ 。
(2)G与J形成原子数之比为 的化合物P,P是日常生活中最常见的物质,P分子的结构式为
的化合物P,P是日常生活中最常见的物质,P分子的结构式为___________ ,空间构型为___________ ;元素K与G同主族且位于G的下一周期,P的沸点比元素K的氢化物的沸点高,原因是___________ 。
(3)已知木炭可在G的单质中完全燃烧形成化合物Q,用电子式表示Q的形成过程:___________ 。
(4)元素D的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式为___________ 。
(5)J、F、G、K可以形成原子个数之比为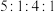 的化合物M,M的化学式为
的化合物M,M的化学式为___________ ;M中含有的化学键类型为___________ 。
(6)下图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是___________。

请回答下列问题:
(1)元素E的原子结构示意图为
(2)G与J形成原子数之比为
 的化合物P,P是日常生活中最常见的物质,P分子的结构式为
的化合物P,P是日常生活中最常见的物质,P分子的结构式为(3)已知木炭可在G的单质中完全燃烧形成化合物Q,用电子式表示Q的形成过程:
(4)元素D的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式为
(5)J、F、G、K可以形成原子个数之比为
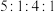 的化合物M,M的化学式为
的化合物M,M的化学式为(6)下图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是___________。
A.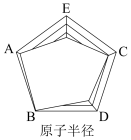 | B.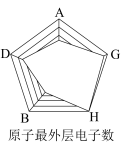 | C.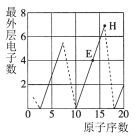 | D.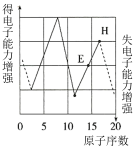 |
您最近一年使用:0次
2022-08-17更新
|
724次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2022-2023学年高一下学期3月月考化学试题



