1 . 2020年,智能材料已大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应 的产物分子中形成配位键提供孤电子对的配位原子名称是
的产物分子中形成配位键提供孤电子对的配位原子名称是______ 。
(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子价电子排布图为______ ,第一电离能介于硼和氮之间的第二周期元素有______ 种。
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于______ (周期,族,区),钛(Ti)的基态原子M能层中有______ 种空间运动状态的电子。
(4)镍能形成多种配合物,如正四面体形的 和正方形的
和正方形的 、正八面体形的
、正八面体形的 等。下列说法正确的有
等。下列说法正确的有______ (填标号)。
A.CO与 互为等电子体,其中CO分子内
互为等电子体,其中CO分子内 键和
键和 键个数之比为1∶2
键个数之比为1∶2
B. 在形成配合物时,其配位数只能为4
在形成配合物时,其配位数只能为4
C.沸点: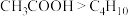 ,因为
,因为 分子间范德华力更强
分子间范德华力更强
D.键角: ,因为
,因为 的成键电子对间的排斥力更大
的成键电子对间的排斥力更大
E.极性:F―C>Cl―C,因此酸性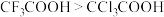
(5)一种四方结构( )的超导化合物汞钡铜氧晶体的晶胞如图所示。
)的超导化合物汞钡铜氧晶体的晶胞如图所示。______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应
 的产物分子中形成配位键提供孤电子对的配位原子名称是
的产物分子中形成配位键提供孤电子对的配位原子名称是(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子价电子排布图为
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于
(4)镍能形成多种配合物,如正四面体形的
 和正方形的
和正方形的 、正八面体形的
、正八面体形的 等。下列说法正确的有
等。下列说法正确的有A.CO与
 互为等电子体,其中CO分子内
互为等电子体,其中CO分子内 键和
键和 键个数之比为1∶2
键个数之比为1∶2B.
 在形成配合物时,其配位数只能为4
在形成配合物时,其配位数只能为4C.沸点:
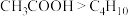 ,因为
,因为 分子间范德华力更强
分子间范德华力更强D.键角:
 ,因为
,因为 的成键电子对间的排斥力更大
的成键电子对间的排斥力更大E.极性:F―C>Cl―C,因此酸性
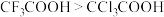
(5)一种四方结构(
 )的超导化合物汞钡铜氧晶体的晶胞如图所示。
)的超导化合物汞钡铜氧晶体的晶胞如图所示。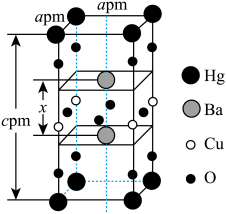
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2 . 锰酸锂( )是锂电池的正极材料,有望取代
)是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为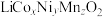 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下:
(1)Ni位于元素周期表中___________ 区;基态Mn原子的价层电子轨道表示式为___________ 。
(2)“灼烧”的目的是___________ 。
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是___________ 。
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是___________ (用离子方程式表示,加入 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还可能有的实验现象是
形式存在)。“紫红色褪去”后,还可能有的实验现象是___________ 。
(5)“合成”在600~750℃下进行,写出发生反应的化学方程式:___________ 。
(6) 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm,
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm, ,
,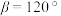 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。___________ 。
②该晶体的密度为___________  。
。
 )是锂电池的正极材料,有望取代
)是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为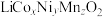 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下: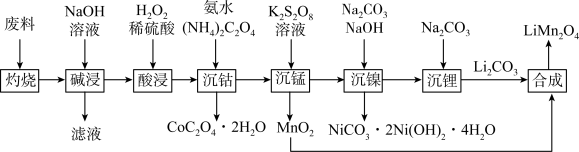
(1)Ni位于元素周期表中
(2)“灼烧”的目的是
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是
 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还可能有的实验现象是
形式存在)。“紫红色褪去”后,还可能有的实验现象是(5)“合成”在600~750℃下进行,写出发生反应的化学方程式:
(6)
 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm,
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm, ,
,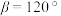 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
②该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
3 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和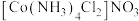 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,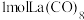 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和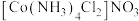 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是 含
含 键。
键。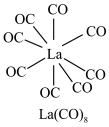
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)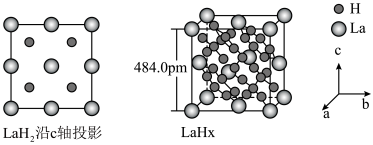
您最近一年使用:0次
名校
解题方法
4 . 磷酸亚铁锂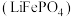 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
(1)操作1、操作2的实验名称为_______ 。
(2)加入 溶液的目的是
溶液的目的是_______ ,聚丙烯的作用是_______ 。
(3)向滤液2中加入 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为_______ ;反应生成 的离子方程式为
的离子方程式为_______ 。
(4)已知: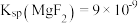 、
、 。若取
。若取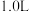 废液,测得
废液,测得 浓度为
浓度为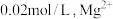 浓度为
浓度为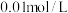 ,则至少需加入
,则至少需加入_______ 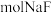 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
(5)锂离子电池充电时, 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成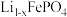 ,当
,当 时,则电极材料中
时,则电极材料中
_______ 。
(6)已知 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。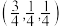 的
的 原子
原子_______ (在图中标出 ,可用头指明)。
,可用头指明)。
②距离 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为_______ 。
③该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。
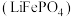 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
| 物质 |  |  |  |  |  |
 |  | 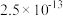 | 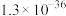 |  |  |
(1)操作1、操作2的实验名称为
(2)加入
 溶液的目的是
溶液的目的是(3)向滤液2中加入
 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为 的离子方程式为
的离子方程式为(4)已知:
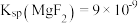 、
、 。若取
。若取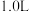 废液,测得
废液,测得 浓度为
浓度为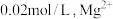 浓度为
浓度为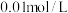 ,则至少需加入
,则至少需加入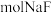 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。(5)锂离子电池充电时,
 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成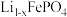 ,当
,当 时,则电极材料中
时,则电极材料中
(6)已知
 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
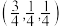 的
的 原子
原子 ,可用头指明)。
,可用头指明)。②距离
 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为③该晶胞的密度为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
5 . 硅(Si)、硒(Se)、镓(Ga)、锗(Ge)的单质及某些化合物都是航空航天测控、光纤通信等领域常用的半导体材料。回答下列问题:
(1)制造手机芯片需要高纯度硅,晶体硅属于___________ 晶体,可溶于氢氟酸生成氢气。写出晶体硅与氢氟酸反应的化学方程式:___________ 。
(2)基态硒原子的价电子排布图为___________ ;硒、硅均能与氢元素形成气态氢化物,硅的氢化物的分子中共用电子对偏向氢原子,而氢气与硒反应时单质硒是氧化剂,则电负性大小为Se___________ (填“>”或“<”)Si, 的立体构型为
的立体构型为___________ 。
(3)镓和砷都是第四周期的元素,则第一电离能:Ga___________ (填“大于”或“小于”)As。GaN、GaAs的晶体类型与晶体硅相同,试解释,熔点GaN>GaAs的原因:___________ 。
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为___________ 。已知晶胞边长为apm,若该晶体的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (只列出计算式即可)。
(1)制造手机芯片需要高纯度硅,晶体硅属于
(2)基态硒原子的价电子排布图为
 的立体构型为
的立体构型为(3)镓和砷都是第四周期的元素,则第一电离能:Ga
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为
 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值

您最近一年使用:0次
6 . 废弃电脑的CPU中含有贵重金属Cu、Ag、Au,可回收利用,部分流程如下:

(1)铜元素在周期表中位于______ ,基态铜原子的核外电子排布式为______ 。
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
(3)用Zn粉还原 的化学反应方程式为
的化学反应方程式为______ ;
(4)试剂1为______ (填名称,下同),试剂2为______ ;
(5)加入过其铁粉的原因是______ ;
(6)滤渣2溶于试剂2的原因是______ ;(用离子反应方程式表示)
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为______  (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

(1)铜元素在周期表中位于
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
| A.NaOH溶液 | B.纯碱溶液 | C.稀硫酸 | D.酒精 |
(3)用Zn粉还原
 的化学反应方程式为
的化学反应方程式为(4)试剂1为
(5)加入过其铁粉的原因是
(6)滤渣2溶于试剂2的原因是
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为
 (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
解题方法
7 . 用熔盐作为化学反应介质,使许多在水溶液中不能进行的反应得以完成,如 的合成是在
的合成是在 熔体中通电,阴极析出的组与通入的
熔体中通电,阴极析出的组与通入的 生成LiH,再与通入的
生成LiH,再与通入的 反应生成
反应生成 。熔盐氟化广泛应用于制造
。熔盐氟化广泛应用于制造 、
、 、
、 、
、 等气体。回答下列问题:
等气体。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为___________ 。氟原子激发态的电子排布式有___________ ,其中能量较高的是___________ (填字母)。
a. b.
b. c.
c.
(2) 的空间构型为
的空间构型为___________ ,N的杂化类型为___________ 。
(3)上述元素F、Si、Cl、S的电负性由大到小的顺序为___________ ,第一电离能由大到小的顺序为___________ 。
(4)CH4、 、
、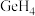 的热稳定性越来越弱,其原因是:
的热稳定性越来越弱,其原因是:___________ ,沸点由大到小的顺序为___________ 。
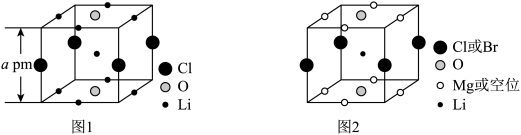
(5)某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。___________  。
。
②图2表示的化学式可以为___________ (填“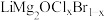 ”或“
”或“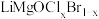 ”)。
”)。
 的合成是在
的合成是在 熔体中通电,阴极析出的组与通入的
熔体中通电,阴极析出的组与通入的 生成LiH,再与通入的
生成LiH,再与通入的 反应生成
反应生成 。熔盐氟化广泛应用于制造
。熔盐氟化广泛应用于制造 、
、 、
、 、
、 等气体。回答下列问题:
等气体。回答下列问题:(1)基态F原子的价电子排布图(轨道表示式)为
a.
 b.
b. c.
c.
(2)
 的空间构型为
的空间构型为(3)上述元素F、Si、Cl、S的电负性由大到小的顺序为
(4)CH4、
 、
、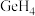 的热稳定性越来越弱,其原因是:
的热稳定性越来越弱,其原因是:(5)某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。
 。
。②图2表示的化学式可以为
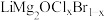 ”或“
”或“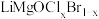 ”)。
”)。
您最近一年使用:0次
解题方法
8 . 不锈钢是由铁、铬、镍、碳及多种不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜 。回答下列问题:
。回答下列问题: 的电子排布式:
的电子排布式:___________ 。基态镍原子的未成对电子数为___________ 。
(2)铁和镍位于元素周期表的同一周期同一族,它们均位于第___________ 周期第___________ 族。
(3)金属铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为: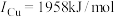 、
、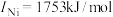 ,
,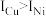 的原因是
的原因是___________ 。
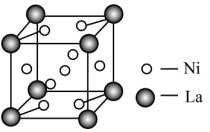
(4)某镍镧合金是优质储氢材料,其晶胞如图所示,则它的化学式为___________ 。 的一种晶体如图甲、乙所示。
的一种晶体如图甲、乙所示。___________ 。
②若按甲中虚线(面对角线)方向切乙,得到的图像正确的是___________ (填字母)。 ,则晶体中铬原子的半径为
,则晶体中铬原子的半径为___________  (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 ,列出表达式)。
,列出表达式)。
 。回答下列问题:
。回答下列问题: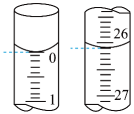
 的电子排布式:
的电子排布式:(2)铁和镍位于元素周期表的同一周期同一族,它们均位于第
(3)金属铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:
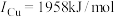 、
、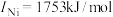 ,
,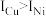 的原因是
的原因是(4)某镍镧合金是优质储氢材料,其晶胞如图所示,则它的化学式为
 的一种晶体如图甲、乙所示。
的一种晶体如图甲、乙所示。
②若按甲中虚线(面对角线)方向切乙,得到的图像正确的是
A. B.
B. C.
C. D.
D.
 ,则晶体中铬原子的半径为
,则晶体中铬原子的半径为 (阿伏加德罗常数的值为
(阿伏加德罗常数的值为 ,列出表达式)。
,列出表达式)。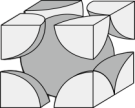
您最近一年使用:0次
名校
解题方法
9 . 以银锰精矿(主要含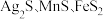 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: 的氧化性强于
的氧化性强于 ;
;
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①“浸锰"过程中,发生反应: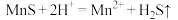 ,则可推断:
,则可推断: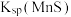
____ (填“ ”或“
”或“ ”)
”)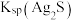 。
。
②在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量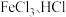 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以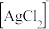 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______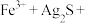 _______
_______ _______
_______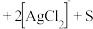 。
。
②结合平衡移动原理,解释浸出剂中 的作用:
的作用:_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有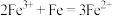 和
和_______ 。
(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图_____ ;基态铁原子核外共有_____ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是_______ 。
③碳与其他元素一起能形成多种酸或酸根。 的空间构型是
的空间构型是_______ 。
④类卤素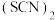 分子中
分子中 键与
键与 键的数目比
键的数目比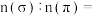
_______ 。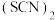 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸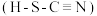 的沸点低于异硫氰酸
的沸点低于异硫氰酸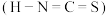 的沸点,其原因是
的沸点,其原因是_______ 。
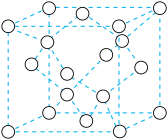
⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体: 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
_______ pm(写出表达式即可)。
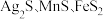 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: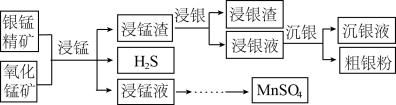
 的氧化性强于
的氧化性强于 ;
;(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①“浸锰"过程中,发生反应:
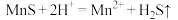 ,则可推断:
,则可推断: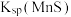
 ”或“
”或“ ”)
”)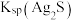 。
。②在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
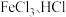 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以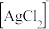 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______
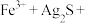 _______
_______ _______
_______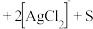 。
。②结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有
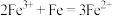 和
和(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是③碳与其他元素一起能形成多种酸或酸根。
 的空间构型是
的空间构型是④类卤素
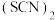 分子中
分子中 键与
键与 键的数目比
键的数目比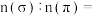
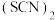 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸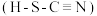 的沸点低于异硫氰酸
的沸点低于异硫氰酸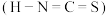 的沸点,其原因是
的沸点,其原因是⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体:
 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
您最近一年使用:0次
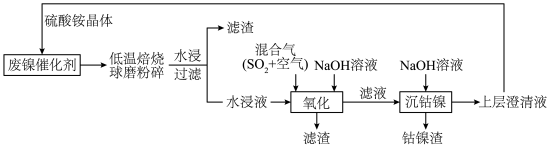
10 . 一种废镍催化剂回收镍、钴元素的工艺流程图如下,流程图中水浸液中含有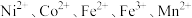 。
。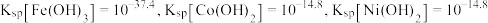 。
。
回答下列问题。
(1)球磨粉碎的作用是_______ 。
(2)“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸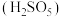 ,其反应的化学方程式为
,其反应的化学方程式为_______ 。
(3)“氧化”中, 被过一硫酸氧化为
被过一硫酸氧化为 沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:
沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:_______ (已知 的电离第一步完全,第二步微弱);用
的电离第一步完全,第二步微弱);用 溶液调节
溶液调节 ,还有
,还有_______ (写离子符号)也会形成沉淀而除去。
(4)“氧化”中保持空气通入速率不变, 的氧化率与
的氧化率与 的体积分数的关系如图所示。
的体积分数的关系如图所示。 的体积分数为9.0%时,
的体积分数为9.0%时, 的氧化率最大;当
的氧化率最大;当 的体积分数大于9.0%时,继续增大
的体积分数大于9.0%时,继续增大 的体积分数,
的体积分数, 的氧化率减小的原因可能是
的氧化率减小的原因可能是_______ 。 沉淀完全,需控制溶液的
沉淀完全,需控制溶液的 不低于
不低于_______ (说明:当溶液中的 浓度均小于
浓度均小于 时,认为已沉淀完全)。
时,认为已沉淀完全)。
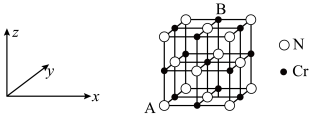
(6)铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示。A点的分数坐标为 ,则B点的分数坐标为
,则B点的分数坐标为_______ 。已知氮化铬的晶胞参数为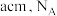 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为_______  。
。
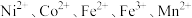 。
。
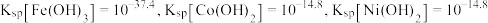 。
。回答下列问题。
(1)球磨粉碎的作用是
(2)“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸
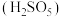 ,其反应的化学方程式为
,其反应的化学方程式为(3)“氧化”中,
 被过一硫酸氧化为
被过一硫酸氧化为 沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:
沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式: 的电离第一步完全,第二步微弱);用
的电离第一步完全,第二步微弱);用 溶液调节
溶液调节 ,还有
,还有(4)“氧化”中保持空气通入速率不变,
 的氧化率与
的氧化率与 的体积分数的关系如图所示。
的体积分数的关系如图所示。 的体积分数为9.0%时,
的体积分数为9.0%时, 的氧化率最大;当
的氧化率最大;当 的体积分数大于9.0%时,继续增大
的体积分数大于9.0%时,继续增大 的体积分数,
的体积分数, 的氧化率减小的原因可能是
的氧化率减小的原因可能是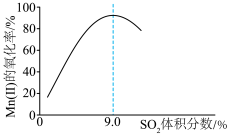
 沉淀完全,需控制溶液的
沉淀完全,需控制溶液的 不低于
不低于 浓度均小于
浓度均小于 时,认为已沉淀完全)。
时,认为已沉淀完全)。(6)铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示。A点的分数坐标为
 ,则B点的分数坐标为
,则B点的分数坐标为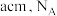 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为 。
。
您最近一年使用:0次



