名校
解题方法
1 . 某兴趣小组用CaS与MgCl2反应制备高纯H2S,实验装置如图所示(装置A内产生的H2S气体中含有酸性气体杂质)不正确 的是
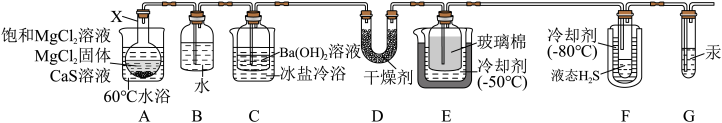
| A.装置A中的反应利用了水解原理 |
| B.为了简化装置,B可以省略 |
| C.装置C中的Ba(OH)2可以换成NaHS |
| D.为了快速排除体系内的空气,可先断开装置F和装置G的连接 |
您最近一年使用:0次
2024-04-10更新
|
587次组卷
|
4卷引用:2024届湖北省荆州中学高三下学期第三次适应性考试化学试卷
2024届湖北省荆州中学高三下学期第三次适应性考试化学试卷浙江省杭州市2024届高三下学期二模化学试题(已下线)压轴题03?物质的制备、检验、分离与提纯(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)压轴题03 物质的制备检验分离与提纯(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
2 . 下列有关说法错误的是
| A.苯酚不慎沾到皮肤上,应立即用乙醇冲洗,并涂上碳酸氢钠溶液 |
B.可降解塑料聚羟基丁酸酯{PHB: }的单体只有1种 }的单体只有1种 |
| C.DNA双螺旋结构中两条链上的碱基通过氢键作用相连 |
| D.误服铅、汞等重金属盐,可口服牛奶、蛋清或豆浆进行初步解毒 |
您最近一年使用:0次
3 . 工业制备高纯硅的主要过程如下:
石英砂 粗硅
粗硅 高纯硅
高纯硅
下列说法错误的是
石英砂
 粗硅
粗硅 高纯硅
高纯硅下列说法错误的是
A.制备粗硅的反应方程式为 |
B.1molSi含Si-Si键的数目约为 |
C.原料气HCl和 应充分去除水和氧气 应充分去除水和氧气 |
D.生成 的反应为熵减过程 的反应为熵减过程 |
您最近一年使用:0次
2023-06-14更新
|
8385次组卷
|
14卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)T3-物质反应及转化(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)第10讲 硅及其化合物(已下线)第7讲 碳、硅及无机非金属材料(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)专题06 元素及其化合物 -2023年高考化学真题题源解密(新高考专用)(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷
4 . 下列实验装置不能达到实验目的的是
| A | B | C | D |
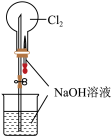 |  | 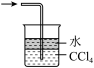 | 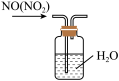 |
| “喷泉实验” | 制备并收集少量氨气 | 吸收氨气,且防止倒吸 | 除去NO中的NO2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-03更新
|
311次组卷
|
2卷引用:湖北省仙桃市 2022-2023学年高一下学期3月调研化学试题
名校
5 . 下列实验方案或实验结论不正确 的是


| A.图(1)可制备氨气并干燥 |
| B.图(2)可用于氨气的尾气吸收 |
| C.图(3)a为干燥HCl气体,b为水,可用于演示喷泉实验 |
| D.图(4)用于比较NaHCO3和Na2CO3的热稳定性 |
您最近一年使用:0次
2023-04-19更新
|
354次组卷
|
3卷引用:湖北省武汉市部分示范学校2022-2023学年高一下学期5月联考化学试题
湖北省武汉市部分示范学校2022-2023学年高一下学期5月联考化学试题浙江省A9协作体2022-2023学年高一下学期期中联考化学试题(已下线)【2023】【高一下】【期中考】【A9桐乡凤鸣高级中学等】【高中化学】【李鼎收集】
名校
解题方法
6 . 三甲基铝 的结构如图所示,在常温常压下为无色透明液体,暴露空气中瞬间着火,与水反应剧烈并生成甲烷。下列推测不合理的是
的结构如图所示,在常温常压下为无色透明液体,暴露空气中瞬间着火,与水反应剧烈并生成甲烷。下列推测不合理的是
 的结构如图所示,在常温常压下为无色透明液体,暴露空气中瞬间着火,与水反应剧烈并生成甲烷。下列推测不合理的是
的结构如图所示,在常温常压下为无色透明液体,暴露空气中瞬间着火,与水反应剧烈并生成甲烷。下列推测不合理的是
A.Al的杂化方式是 |
B. 可与 可与 形成稳定的配合物 形成稳定的配合物 |
C. 与足量 与足量 反应可得到 反应可得到 |
D.若 在空气中发生燃烧,可以用泡沫灭火器灭火 在空气中发生燃烧,可以用泡沫灭火器灭火 |
您最近一年使用:0次
2023-03-26更新
|
821次组卷
|
5卷引用:湖北省华中师范大学第一附属中学2023届高三第二次学业质量评价检测化学试题
湖北省华中师范大学第一附属中学2023届高三第二次学业质量评价检测化学试题湖北省孝感市重点高中教科研协作体2022-2023学年高二下学期4月期中考试化学试题湖北省武汉市武钢三中2022-2023学年高二下学期5月月考化学试题(已下线)【2023】【高三下】【其他】【杭二中-浙湘豫三省联考】【高中化学】【李鼎集】(已下线)晶体结构与性质
7 . 在化学实验中,具有安全意识是重要的科学素养。下列实验操作不正确的有几个
①氢气点燃前,先检验氢气的纯度
②金属钠着火时,用干燥的沙土覆盖
③稀释浓硫酸时,将水沿烧杯内壁倒入浓硫酸中
④称量NaOH固体时,将NaOH固体放在托盘的滤纸上称量
⑤用托盘天平称量5.85 g氯化钠固体
①氢气点燃前,先检验氢气的纯度
②金属钠着火时,用干燥的沙土覆盖
③稀释浓硫酸时,将水沿烧杯内壁倒入浓硫酸中
④称量NaOH固体时,将NaOH固体放在托盘的滤纸上称量
⑤用托盘天平称量5.85 g氯化钠固体
| A.2 | B.4 | C.1 | D.3 |
您最近一年使用:0次
2023-02-11更新
|
80次组卷
|
2卷引用:湖北省部分地区2022-2023学年高一元月期末考试化学试题
8 . 氮元素的单质和常见化合物在工、农业生产中用途广泛。
(1)氮气的化学性质很稳定,可用作灯泡填充气。从分子结构角度解释其原因是_______ 。
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式_______ 。
(3)NO和NO2可用NaOH溶液吸收主要反应为:
NO+NO2+2OH-=2NO +H2O
+H2O
2OH-+2NO2=NO +NO
+NO +H2O
+H2O
①下列措施可能提高尾气中NO和NO2去除率的有_______ (填字母)
A.加快通入尾气的速率。
B.采用气,液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
D.在尾气中同时通入氧气
②吸收后的溶液经浓缩,结晶,过滤,得到NaNO2晶体,该晶体的主要杂质_______ (填化学式)。
(4)铵盐大多在农业上用作化肥,实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为_______ 。欲吸收尾气中的NH3,下列装置不宜选用_______ (填字母) 。(已知氨气难溶于有机溶剂CCl4)
A.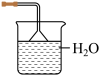 B.
B.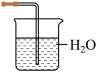 C.
C.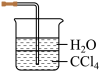 D.
D.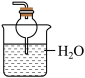
(1)氮气的化学性质很稳定,可用作灯泡填充气。从分子结构角度解释其原因是
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式
(3)NO和NO2可用NaOH溶液吸收主要反应为:
NO+NO2+2OH-=2NO
 +H2O
+H2O2OH-+2NO2=NO
 +NO
+NO +H2O
+H2O①下列措施可能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率。
B.采用气,液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
D.在尾气中同时通入氧气
②吸收后的溶液经浓缩,结晶,过滤,得到NaNO2晶体,该晶体的主要杂质
(4)铵盐大多在农业上用作化肥,实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
9 . 用中子轰击 X原子产生α粒子(即氦核
X原子产生α粒子(即氦核 He)的核反应为:
He)的核反应为: X+
X+ n→
n→ Y+
Y+ He。已知元素Y在化合物中呈+1价。下列说法正确的是
He。已知元素Y在化合物中呈+1价。下列说法正确的是
 X原子产生α粒子(即氦核
X原子产生α粒子(即氦核 He)的核反应为:
He)的核反应为: X+
X+ n→
n→ Y+
Y+ He。已知元素Y在化合物中呈+1价。下列说法正确的是
He。已知元素Y在化合物中呈+1价。下列说法正确的是| A.H3XO3可用于中和溅在皮肤上的NaOH溶液 |
| B.Y单质在空气中燃烧的产物是Y2O2 |
| C.X和氢元素形成离子化合物 |
| D.6Y和7Y互为同素异形体 |
您最近一年使用:0次
2021-06-09更新
|
8596次组卷
|
34卷引用:湖北省十堰市部分重点中学2022-2023学年高二下学期3月联考化学试题
湖北省十堰市部分重点中学2022-2023学年高二下学期3月联考化学试题2021年新高考河北化学高考真题(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江西省赣县第三中学2021-2022学年高二上学期入学考试化学试题河南省信阳高级中学2021-2022学年高二上学期9月月考化学试题(已下线)专题05 物质结构和元素周期律-备战2022年高考化学学霸纠错(全国通用)天津市第一中学2021-2022学年高三上学期第二次月考化学试题2021年河北省高考化学试卷变式题1-9题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题09 物质结构 元素周期律-2022年高考化学二轮复习重点专题常考点突破练(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)吉林省长春市2022届普通高中高三质量监测(五)理综化学试题(已下线)专题01 STSE 化学用语-三年(2020-2022)高考真题分项汇编(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编(已下线)考点06 原子结构-备战2023年高考化学一轮复习考点帮(全国通用)四川省内江市2021-2022学年高一下学期期末检测理科化学试题(已下线)第09练 原子结构与元素周期表-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第13讲 原子结构 化学键(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第13讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(新教材新高考)河北省衡水阳光中学2022-2023学年高二上学期第一次阶段考试化学试题(已下线)专题07 元素周期律与元素周期表(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第26讲 原子结构核 外电子排布原理黑龙江省哈尔滨市第九中学2022-2023学年高二上学期期末化学试题(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)安徽省合肥市第一中学2022-2023学年高二下学期期中考试化学试题(已下线)考点06 原子结构(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第1讲 原子结构 核外电子排布(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)甘肃省天水市甘谷县第三中学2023-2024学年高一上学期12月第三次月考化学试卷
名校
解题方法
10 . 乙酰苯胺(C6H5-NHCOCH3)可用作止痛剂退热剂、防腐剂和染料中间体,常用苯胺(C6H5-NH2)与冰醋酸为原料制备,具体流程如下:
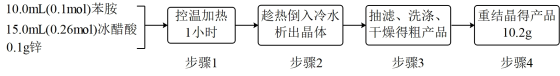
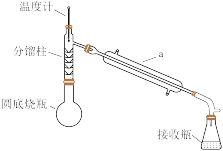
化学原理:C6H5-NH2 + CH3COOH C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。
C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。
请回答下列问题:
(1)仪器a的名称___________
(2)盛有冰醋酸的容器,最有可能贴有的安全标签是___________ (填标号)。
a. b.
b.  c.
c. d.
d.
(3)加入锌粒,除了防止暴沸外,还能起到的作用是___________
(4)步骤1中控制温度计示数约105 °C的原因是___________
(5)判断反应基本完全的现象是___________ ;步骤3中洗涤乙酰苯胺粗产品最合适的试剂是___________ (填标号)。
a.冰水 b.热水 c.15%的乙醇溶液 d. NaOH溶液
(6)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→___________ →冷却结晶→过滤→洗涤→干燥。
(7)本实验中乙酰苯胺产率为___________ 。

化学原理:C6H5-NH2 + CH3COOH
 C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。
C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。
名称 | 熔点/℃ | 沸点/℃ | 溶解度/g(20℃) | |
水 | 乙醇 | |||
苯胺 | -6.3 | 184 | 3.4 | 任意比混合 |
冰醋酸 | 16.6 | 118 | 任意比混合 | 任意比混合 |
乙酰苯胺 | 114.3 | 304 | 0.46 | 36.9 |
(温度高溶解度大) | ||||
(1)仪器a的名称
(2)盛有冰醋酸的容器,最有可能贴有的安全标签是
a.
 b.
b.  c.
c. d.
d.
(3)加入锌粒,除了防止暴沸外,还能起到的作用是
(4)步骤1中控制温度计示数约105 °C的原因是
(5)判断反应基本完全的现象是
a.冰水 b.热水 c.15%的乙醇溶液 d. NaOH溶液
(6)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→
(7)本实验中乙酰苯胺产率为
您最近一年使用:0次
2021-06-01更新
|
290次组卷
|
4卷引用:湖北省武汉市2020届高三毕业生六月供题(二)理科综合化学试题
湖北省武汉市2020届高三毕业生六月供题(二)理科综合化学试题广东省中山市华南师范大学中山附属中学2020-2021学年高二下学期第二次月考化学试题福建省莆田二中、晋江一中、南安一中2019-2020学年高二下学期三校期末联考化学试题(已下线)考点29 试剂存放与实验安全-备战2022年高考化学一轮复习考点帮(浙江专用)



