1 . 如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
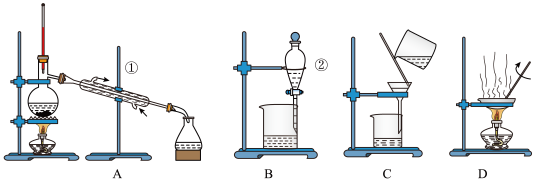
(1)从氯化钾溶液中得到氯化钾固体,选择装置_______ (填上图的字母);除去自来水中的 等杂质,选择装置
等杂质,选择装置_______ (填上图的字母),分离方法的名称_______ 。
(2)分离植物油和水选择装置_______ (填上图的字母),该分离方法的名称为_______ 。
(3)除去氯化钠溶液中的硫酸钡,选择装置_______ (填上图的字母)。
(4)从海水中提取蒸馏水、溴、食盐过程过如图:
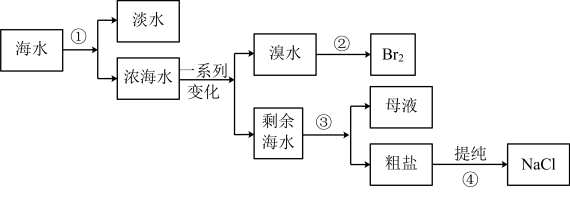
①从海水中获取淡水的方法是选择装置A,A仪器①的名称是_______ ,进水的方向是从_______ (填“上”或“下”)口进水。
②从溴水中获得单质溴时,采用的方法是萃取、_______ (填上图的字母)、蒸馏。下列可选作萃取剂的是_______ 。
A. 酒精 B. 苯 C.
(5)粗盐含有 、
、 、
、 等离子,为除去以上杂质离子,可加入①
等离子,为除去以上杂质离子,可加入① 溶液 ②
溶液 ② 溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。
溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。
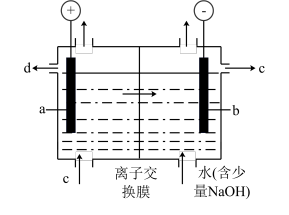
(6)氯碱工业用离子交换膜法电解饱和食盐水,装置示意图如图。下列说法错误的是
(7)某溶液中含有较大量的 、
、 、
、 等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。
等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。
①滴加过量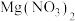 溶液 ②过滤 ③滴加
溶液 ②过滤 ③滴加 溶液 ④加
溶液 ④加 溶液
溶液

(1)从氯化钾溶液中得到氯化钾固体,选择装置
 等杂质,选择装置
等杂质,选择装置(2)分离植物油和水选择装置
(3)除去氯化钠溶液中的硫酸钡,选择装置
(4)从海水中提取蒸馏水、溴、食盐过程过如图:

①从海水中获取淡水的方法是选择装置A,A仪器①的名称是
②从溴水中获得单质溴时,采用的方法是萃取、
A. 酒精 B. 苯 C.

(5)粗盐含有
 、
、 、
、 等离子,为除去以上杂质离子,可加入①
等离子,为除去以上杂质离子,可加入① 溶液 ②
溶液 ② 溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。
溶液 ③NaOH溶液 ④过滤 ⑤稀盐酸。错误的操作顺序是_______。| A.①②③④⑤ | B.②①③④⑤ | C.③②①④⑤ | D.②③①④⑤ |

| A.a为阳极,发生氧化反应生成氯气 |
B.b极的电极反应式为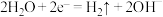 |
| C.检验阳极产物时用湿润的淀粉碘化钾试纸,试纸变蓝 |
| D.通电一段时间后,阴极区pH降低 |
 、
、 、
、 等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。
等三种阴离子,如果只取一次该溶液就能够将三种阴离子依次检验出来,下列实验操作顺序正确的是_______。①滴加过量
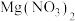 溶液 ②过滤 ③滴加
溶液 ②过滤 ③滴加 溶液 ④加
溶液 ④加 溶液
溶液| A.④②①②③ | B.①②④②③ | C.①②③②④ | D.④②③②① |
您最近一年使用:0次
2 . 2021年10月河南省地矿局发现一特大型金矿。下图为纯化黄金(纯度>90%,含铁、铜化合物等杂质)的工艺流程图。下列说法不正确的是


A.往四氯金酸中加入 溶液,当 溶液,当 被氧化时,反应转移1.5mol电子 被氧化时,反应转移1.5mol电子 |
B.王水溶金生成 和NO的化学方程式为 和NO的化学方程式为 |
| C.实验室进行操作A用到的玻璃仪器有漏斗、玻璃棒、烧杯 |
| D.操作A所得金粉会吸附铁的化合物,加盐酸的目的是为了将吸附的杂质溶解除去 |
您最近一年使用:0次
2022-04-11更新
|
629次组卷
|
4卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
名校
解题方法
3 . 乙酰苯胺(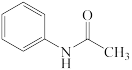 )在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(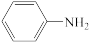 )和乙酸酐(
)和乙酸酐(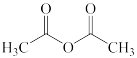 )反应制得。
)反应制得。
已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
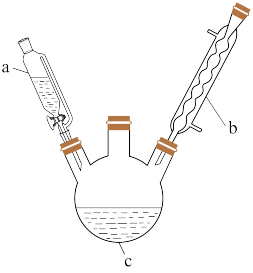
实验室制备乙酰苯胺的步骤如下(部分装置省略):
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)乙酸酐放入三口烧瓶c中,在恒压滴液漏斗a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用_______洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,_______,称量产品为3.28g。
回答下列问题:
(1)仪器b的名称是_______ 。
(2)写出反应的化学方程式_______ 。
(3)减压过滤的优点是_______ ;步骤I用滤液而不用冷水冲洗烧杯的原因是_______ ;洗涤晶体宜选用_______ (填字母)。
A.乙醇 B.CCl4 C.冷水 D.乙醚
(4)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是_______ 。
(5)步骤Ⅱ中,称量前的操作是_______ 。上述提纯乙酰苯胺的方法叫_______ 。
(6)乙酰苯胺的产率为_______ 。(计算结果保留3位有效数字)
 )在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺( )和乙酸酐(
)和乙酸酐( )反应制得。
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
| 温度 | 20 | 25 | 50 | 80 | 100 |
| 溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)乙酸酐放入三口烧瓶c中,在恒压滴液漏斗a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用_______洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。

Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,_______,称量产品为3.28g。
回答下列问题:
(1)仪器b的名称是
(2)写出反应的化学方程式
(3)减压过滤的优点是
A.乙醇 B.CCl4 C.冷水 D.乙醚
(4)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是
(5)步骤Ⅱ中,称量前的操作是
(6)乙酰苯胺的产率为
您最近一年使用:0次
2021-03-05更新
|
1346次组卷
|
9卷引用:广东省广州市番禺区2022-2023学年高二下学期期末教学质量监测化学试题
广东省广州市番禺区2022-2023学年高二下学期期末教学质量监测化学试题重庆市重点中学2021届高三下学期开学考试(新高考)化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市第七中学2021-2022学年高三下学期1月月考理科综合化学试题(已下线)专题十八化学实验综合题解题策略(已下线)05 以分离提纯为主线的有机制备类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)陕西省西安市铁一中学2023-2024学年高二下学期第一次月考化学试题
4 . 过氧化钙晶体( )常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。

回答下列问题:
(1)反应①的离子方程式为______ ;过滤过程中用到的玻璃仪器有烧杯、漏斗、______ 。
(2)用上述方法制取 的化学方程式为
的化学方程式为______ 。
(3)操作②温度不宜过高,其可能原因是______ 。
(4)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为: ,某同学准确称取
,某同学准确称取 产品于有塞锥形瓶中,用适量酸溶解,加入
产品于有塞锥形瓶中,用适量酸溶解,加入 的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为______ (用含a、b、c的代数式表示)。
 )常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
回答下列问题:
(1)反应①的离子方程式为
(2)用上述方法制取
 的化学方程式为
的化学方程式为(3)操作②温度不宜过高,其可能原因是
(4)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:
 ,某同学准确称取
,某同学准确称取 产品于有塞锥形瓶中,用适量酸溶解,加入
产品于有塞锥形瓶中,用适量酸溶解,加入 的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
您最近一年使用:0次
5 . 己二酸在化工生产中有重要作用。某兴趣小组用50%的硝酸作氧化剂.钒酸铵作催化剂,氧化环己醇制备己二酸,其反应原理为3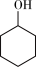 +8HNO3
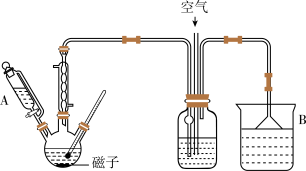
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出己二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)仪器A的名称为____________ ,仪器B中所盛装的试剂为____________ 。
(2)实验过程中,最适宜的加热方法为____________ ;该加热方法的优点是____________ 。
(3)本实验中称量钒酸铵的仪器应选用____________ (填“托盘天平”或“电子天平”)。
(4)减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:____________ 。
(5)为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是____________ (填标号)。
A使用甲基橙作指示剂
B.滴定前俯视读数,滴定后仰视读数
C.实验用的碱滴定管、锥形瓶水洗后均未润洗
 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出己二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)仪器A的名称为
(2)实验过程中,最适宜的加热方法为
(3)本实验中称量钒酸铵的仪器应选用
(4)减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:
(5)为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是
A使用甲基橙作指示剂
B.滴定前俯视读数,滴定后仰视读数
C.实验用的碱滴定管、锥形瓶水洗后均未润洗
您最近一年使用:0次
6 . 溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢被氧化。实验室制备 的步骤如下:
的步骤如下:
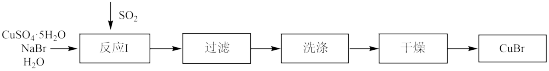
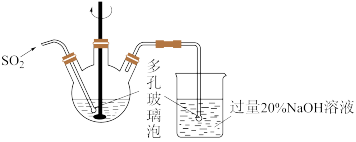
(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的_________ (写化学式)。
(2)反应Ⅰ中:三颈烧瓶中反应生成 的离子方程式为
的离子方程式为________ ;烧杯中发生反应的化学方程式为________ 。
(3)过滤步骤中,需要在避光的条件下进行,原因是________ 。
(4)洗涤步骤中,依次用溶有少量 的水、溶有少量
的水、溶有少量 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有 ”的原因是
”的原因是________ 。
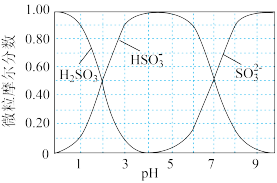
(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水 晶体。
晶体。
(水溶液中 、
、 、
、 随
随 的分布,
的分布, 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。

请补充完整实验方案[须用到  (贮存在钢瓶中)、
(贮存在钢瓶中)、 计]:
计]:
①________ ;
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③________ ;
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
 的步骤如下:
的步骤如下:

(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的
(2)反应Ⅰ中:三颈烧瓶中反应生成
 的离子方程式为
的离子方程式为(3)过滤步骤中,需要在避光的条件下进行,原因是
(4)洗涤步骤中,依次用溶有少量
 的水、溶有少量
的水、溶有少量 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有 ”的原因是
”的原因是(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水
 晶体。
晶体。(水溶液中
 、
、 、
、 随
随 的分布,
的分布, 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。

请补充完整实验方案[
 (贮存在钢瓶中)、
(贮存在钢瓶中)、 计]:
计]:①
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
您最近一年使用:0次
7 . 过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
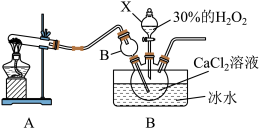
①装置A中发生反应的化学方程式为____________ 。
②装置C采用冰水浴控制温度在0 ℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.__________________________________ 。
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为:______ 。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应(I-被氧化I2)。
步骤二:向上述锥形瓶中加入几滴淀粉溶液以指示反应的终点。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出3次平均消耗Na2S2O3溶液体积为V mL。发生的反应为:I2+2S2O32-=2I-+S4O62-,产品中CaO2·8H2O的质量分数为____ (用含字母的代数式表示)。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。

①装置A中发生反应的化学方程式为
②装置C采用冰水浴控制温度在0 ℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为:
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应(I-被氧化I2)。
步骤二:向上述锥形瓶中加入几滴淀粉溶液以指示反应的终点。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出3次平均消耗Na2S2O3溶液体积为V mL。发生的反应为:I2+2S2O32-=2I-+S4O62-,产品中CaO2·8H2O的质量分数为
您最近一年使用:0次
8 . 用下列实验装置和方法进行相应实验,能达到实验目的的是
A.用装置 制备S02 制备S02 |
B.用装置 从碘水溶液中萃取碘 从碘水溶液中萃取碘 |
C.用装置 除去粗盐溶液中混有的KC1杂质 除去粗盐溶液中混有的KC1杂质 |
D.用装置 制取NH3 制取NH3 |
您最近一年使用:0次
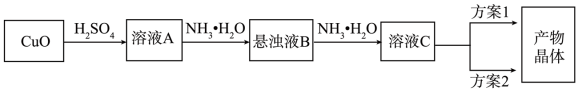
9 . 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
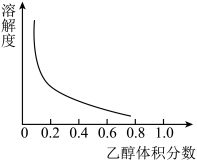
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____ 。
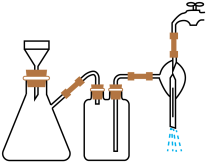
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____ 杂质,产生该杂质的原因是______ 。
(2)方案2的实验步骤为:a.向溶液C中加入适量____ ,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________ 。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________ 。
③步骤d采用________ 干燥的方法。

相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+
 Cu2++4NH3
Cu2++4NH3②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图

请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是

A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有
(2)方案2的实验步骤为:a.向溶液C中加入适量
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:
③步骤d采用
您最近一年使用:0次
2019-06-29更新
|
362次组卷
|
2卷引用:浙江省嘉兴市2018-2019学年高二下学期期末考试化学试题
名校
解题方法
10 . I.一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.某同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷.

(1)无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为__________________________
(2)装置B的主要作用是____________________
(3)收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L﹣1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L﹣1盐酸标准液对吸收液进行返滴定(发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为_______ mol.
(已知:2CH3Cl+3O2 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
II. 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O==Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)实验室进行“过滤”操作使用的玻璃仪器除烧杯外主要有____________________________________ 。
(2)流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是________________________________________ 。

(1)无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为
(2)装置B的主要作用是
(3)收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L﹣1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L﹣1盐酸标准液对吸收液进行返滴定(发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为
(已知:2CH3Cl+3O2
 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)II. 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O==Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)实验室进行“过滤”操作使用的玻璃仪器除烧杯外主要有
(2)流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
您最近一年使用:0次



