1 . 物质的性质除主要与物质的结构有关外还与外界条件有关。有人提出“ 与干燥的
与干燥的 不反应”和“
不反应”和“ 与潮湿的
与潮湿的 才能反应”,某小组设计如下实验路线。
才能反应”,某小组设计如下实验路线。___________ 。
(2)为了验证 与干燥的
与干燥的 是否反应,连接好装置,X是
是否反应,连接好装置,X是___________ 。打开___________ ,关闭___________ ,打开分液漏斗的活塞加入稀硫酸,产生气体一段时间,再在干燥管中装入干燥的 ,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是
,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是___________ 。
(3)若打开 ,关闭
,关闭 ,加入稀硫酸,点燃酒精灯,观察到
,加入稀硫酸,点燃酒精灯,观察到___________ 现象,___________ (选填“能”或“不能”)证明潮湿的 与
与 反应产生了
反应产生了 。请用化学方程式解释产生该现象的原因
。请用化学方程式解释产生该现象的原因___________ 。
(4)为验证第(3)实验产生的现象 是否与
是否与 反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加
反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加___________ ,产生___________ 现象说明 参与反应。
参与反应。
 与干燥的
与干燥的 不反应”和“
不反应”和“ 与潮湿的
与潮湿的 才能反应”,某小组设计如下实验路线。
才能反应”,某小组设计如下实验路线。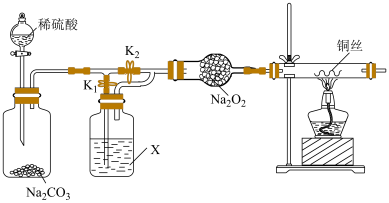
(2)为了验证
 与干燥的
与干燥的 是否反应,连接好装置,X是
是否反应,连接好装置,X是 ,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是
,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是(3)若打开
 ,关闭
,关闭 ,加入稀硫酸,点燃酒精灯,观察到
,加入稀硫酸,点燃酒精灯,观察到 与
与 反应产生了
反应产生了 。请用化学方程式解释产生该现象的原因
。请用化学方程式解释产生该现象的原因(4)为验证第(3)实验产生的现象
 是否与
是否与 反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加
反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加 参与反应。
参与反应。
您最近一年使用:0次
2 . 某小组同学利用以下实验装置研究SO2的性质(经检验,装置的气密性良好)。实验过程中遇到以下问题:___________ 。
(2)ii中观察品红溶液现象___________ 。结论是:SO2有___________ 性。
(3)iii中石蕊溶液变___________ ,说明SO2与H2O反应生成了酸性物质。
(4)iv中观察到的现象是___________ ,离子方程式是:___________ ,结论是:SO2有___________ 性。
(5)v中产生现象___________ ,结论是:SO2有___________ 性。
(6)NaOH溶液的作用是___________ 。反应的离子方程式___________ 。
(7)若将铜丝换成足量铁丝与一定量浓H2SO4反应,随着硫酸溶液变稀得到的两种气体产物依次为___________ 、___________ 。

(2)ii中观察品红溶液现象
(3)iii中石蕊溶液变
(4)iv中观察到的现象是
(5)v中产生现象
(6)NaOH溶液的作用是
(7)若将铜丝换成足量铁丝与一定量浓H2SO4反应,随着硫酸溶液变稀得到的两种气体产物依次为
您最近一年使用:0次
名校
3 . 铜与浓硝酸反应,装置如图。
(1)铜与浓 反应的化学方程式为
反应的化学方程式为___________ 。
(2)分别取3mL浓 与不同质量的纯铜片(铜片均完成溶解)充分反应,反应剧烈,纯铜片逐渐溶解,试管内呈现
与不同质量的纯铜片(铜片均完成溶解)充分反应,反应剧烈,纯铜片逐渐溶解,试管内呈现___________ 色气体,溶液颜色发生变化如下:
取2份等体积①中溶液以相同流速分别通入 和空气,观察现象如下:
和空气,观察现象如下:
溶液呈绿色的可能原因为___________ (填标号),通入气体后,溶液由绿色变为蓝色的原因为___________ (填标号)。
A.硝酸铜溶液就是绿色
B.硝酸铜溶液浓度大
C. 溶解在硝酸铜溶液中
溶解在硝酸铜溶液中
D.溶液通入 时,
时, 被缓慢氧化为
被缓慢氧化为
E.溶液含有某种与绿色有关的还原性微粒,通入空气时较快被氧化
F.空气中的 溶于水显酸性,促进了溶液变蓝色
溶于水显酸性,促进了溶液变蓝色
(3)查阅文献知, 在溶液中存在如下反应:
在溶液中存在如下反应:
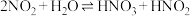 ,
,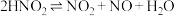
取3份等体积的①中绿色溶液,分别加入不同物质,现象如下:
加入 后溶液迅速变蓝,原因是
后溶液迅速变蓝,原因是 可能参与了下列反应(用化学方程式表示):
可能参与了下列反应(用化学方程式表示):
 ,
,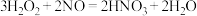 ,
,___________ 。
(4)综上分析,本实验中尾气处理反应的离子方程式为___________ ,硝酸铜溶液中存在___________ (填化学式)参与了形成绿色溶液的过程。

(1)铜与浓
 反应的化学方程式为
反应的化学方程式为(2)分别取3mL浓
 与不同质量的纯铜片(铜片均完成溶解)充分反应,反应剧烈,纯铜片逐渐溶解,试管内呈现
与不同质量的纯铜片(铜片均完成溶解)充分反应,反应剧烈,纯铜片逐渐溶解,试管内呈现| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
 和空气,观察现象如下:
和空气,观察现象如下:| 通入气体 |  | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
A.硝酸铜溶液就是绿色
B.硝酸铜溶液浓度大
C.
 溶解在硝酸铜溶液中
溶解在硝酸铜溶液中 D.溶液通入
 时,
时, 被缓慢氧化为
被缓慢氧化为
E.溶液含有某种与绿色有关的还原性微粒,通入空气时较快被氧化
F.空气中的
 溶于水显酸性,促进了溶液变蓝色
溶于水显酸性,促进了溶液变蓝色(3)查阅文献知,
 在溶液中存在如下反应:
在溶液中存在如下反应: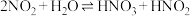 ,
,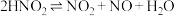
取3份等体积的①中绿色溶液,分别加入不同物质,现象如下:
| 加入物质 |  | 3滴30% 溶液 溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
 后溶液迅速变蓝,原因是
后溶液迅速变蓝,原因是 可能参与了下列反应(用化学方程式表示):
可能参与了下列反应(用化学方程式表示): ,
,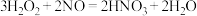 ,
,(4)综上分析,本实验中尾气处理反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 二氧化硫和亚硫酸在工农业生产中具有重要的用途。某化学兴趣小组对 和
和 的一些性质进行了探究。回答下列问题:
的一些性质进行了探究。回答下列问题:
Ⅰ.某同学设计了如图装置用于制取 和验证
和验证 的性质。
的性质。 具有一定氧化性。
具有一定氧化性。
(1)装置A中发生反应的化学方程式为___________ 。
(2)在框图内选择合适装置依次验证 的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→
的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→___________ (填装置字母,还原性设计两个装置)。
(3)实验前必须鼓入 ,目的是
,目的是___________ 。
(4)装置F中产生了白色沉淀,其成分是___________ (化学式)。
(5)实验中发现装置A中 可能部分被氧化,现需测定
可能部分被氧化,现需测定 的纯度:称取
的纯度:称取 样品,配成
样品,配成 溶液;取其中的
溶液;取其中的 溶液,与
溶液,与 酸性
酸性 溶液发生以下反应:
溶液发生以下反应: ,实验消耗
,实验消耗 溶液
溶液 ,以上样品中
,以上样品中 的质量分数为
的质量分数为___________ (保留三位有效数字)。
Ⅱ.探究 的酸性强于
的酸性强于 (可能所需要的装置和试剂如图所示)。
(可能所需要的装置和试剂如图所示)。___________ (填装置标号)。
(7)能证明 的酸性强于
的酸性强于 的现象
的现象___________ 。
 和
和 的一些性质进行了探究。回答下列问题:
的一些性质进行了探究。回答下列问题:Ⅰ.某同学设计了如图装置用于制取
 和验证
和验证 的性质。
的性质。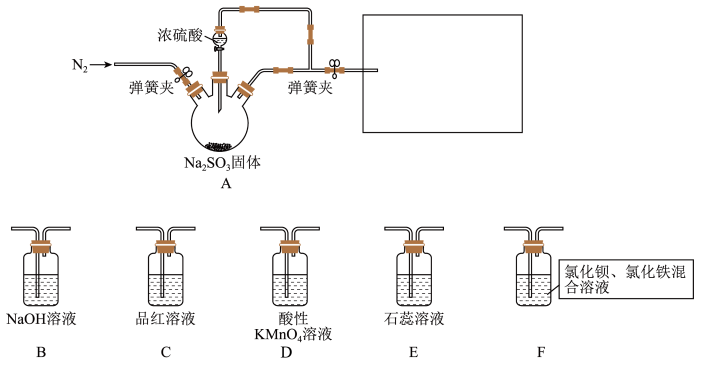
 具有一定氧化性。
具有一定氧化性。(1)装置A中发生反应的化学方程式为
(2)在框图内选择合适装置依次验证
 的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→
的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→(3)实验前必须鼓入
 ,目的是
,目的是(4)装置F中产生了白色沉淀,其成分是
(5)实验中发现装置A中
 可能部分被氧化,现需测定
可能部分被氧化,现需测定 的纯度:称取
的纯度:称取 样品,配成
样品,配成 溶液;取其中的
溶液;取其中的 溶液,与
溶液,与 酸性
酸性 溶液发生以下反应:
溶液发生以下反应: ,实验消耗
,实验消耗 溶液
溶液 ,以上样品中
,以上样品中 的质量分数为
的质量分数为Ⅱ.探究
 的酸性强于
的酸性强于 (可能所需要的装置和试剂如图所示)。
(可能所需要的装置和试剂如图所示)。
(7)能证明
 的酸性强于
的酸性强于 的现象
的现象
您最近一年使用:0次
解题方法
5 . 某实验小组在探究 性质时,做了如下实验:
性质时,做了如下实验:
实验Ⅰ:向NaCl溶液中加入 溶液,溶液呈绿色。
溶液,溶液呈绿色。
实验Ⅱ:向 溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。
溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。
实验Ⅲ:向 溶液中加入适量氨水,溶液变为深蓝色。
溶液中加入适量氨水,溶液变为深蓝色。
实验Ⅳ:向实验Ⅲ的深蓝色溶液中加入 溶液,产生蓝色沉淀。
溶液,产生蓝色沉淀。
资料显示: 为黄色,
为黄色,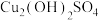 为绿色不溶物。
为绿色不溶物。
下列说法错误的是
 性质时,做了如下实验:
性质时,做了如下实验:实验Ⅰ:向NaCl溶液中加入
 溶液,溶液呈绿色。
溶液,溶液呈绿色。实验Ⅱ:向
 溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。
溶液中加入表面打磨掉氧化膜的金属Mg,产生大量气泡同时溶液中产生绿色沉淀。实验Ⅲ:向
 溶液中加入适量氨水,溶液变为深蓝色。
溶液中加入适量氨水,溶液变为深蓝色。实验Ⅳ:向实验Ⅲ的深蓝色溶液中加入
 溶液,产生蓝色沉淀。
溶液,产生蓝色沉淀。资料显示:
 为黄色,
为黄色,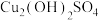 为绿色不溶物。
为绿色不溶物。下列说法错误的是
A.实验Ⅰ: 在NaCl溶液中部分转化为 在NaCl溶液中部分转化为 |
B.实验Ⅱ:Mg消耗了溶液中的 从而产生了 从而产生了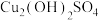 |
C.实验Ⅲ:有 生成 生成 |
D.实验Ⅳ:获得的蓝色沉淀为 |
您最近一年使用:0次
6 . 如图是实验室用二氧化锰和浓盐酸制备氯气并进行一系列相关实验的装置(夹持装置已略)。

(1)装置A中盛装浓盐酸的仪器名称为________ ,发生反应的离子方程式为________ 。
(2)装置B中盛装的试剂为________ ,在实验过程中可以起到安全瓶的作用,一旦后续装置堵塞,B中会出现________ 现象。
(3)装置C的作用是证明干燥的 无漂白性,但其水溶液具有漂白性,则Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是
无漂白性,但其水溶液具有漂白性,则Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是________ (填字母,试剂不重复使用)。
a.干燥的石蕊试纸 b.湿润的石蕊试纸
c.碱石灰 d.无水氯化钙
(4)装置E中溶液变蓝色,证明了氯气化学性质中的________ 性;装置F中的试剂为________ 溶液(填化学式)。
(5) 也可以与浓盐酸反应生成氯气,是实验室快速制氯气的方法之一,分别使用
也可以与浓盐酸反应生成氯气,是实验室快速制氯气的方法之一,分别使用 和
和 制备等量的氯气,转移电子数之比为
制备等量的氯气,转移电子数之比为________ 。

(1)装置A中盛装浓盐酸的仪器名称为
(2)装置B中盛装的试剂为
(3)装置C的作用是证明干燥的
 无漂白性,但其水溶液具有漂白性,则Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是
无漂白性,但其水溶液具有漂白性,则Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是a.干燥的石蕊试纸 b.湿润的石蕊试纸
c.碱石灰 d.无水氯化钙
(4)装置E中溶液变蓝色,证明了氯气化学性质中的
(5)
 也可以与浓盐酸反应生成氯气,是实验室快速制氯气的方法之一,分别使用
也可以与浓盐酸反应生成氯气,是实验室快速制氯气的方法之一,分别使用 和
和 制备等量的氯气,转移电子数之比为
制备等量的氯气,转移电子数之比为
您最近一年使用:0次
名校
解题方法
7 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。(已知:C+2H2SO4(浓) CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___________ 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。___________ ;装置C中品红溶液的作用是___________ 。
②装置H的作用为___________ 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。___________ ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___________ (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为___________ 。
 CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)(1)有同学认为制得的SO2中可能混有杂质,其化学式为
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。

②装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。

②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是
您最近一年使用:0次
2024-02-28更新
|
650次组卷
|
7卷引用:辽宁省长海县高级中学2023-2024下学期第一次月考高一化学试卷
辽宁省长海县高级中学2023-2024下学期第一次月考高一化学试卷江西省丰城中学2023-2024学年高一下学期开学化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题湖南省常德市第一中学2023-2024学年高一下学期第一次月考化学试题天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)
8 . 某实验小组用漂白粉[主要成分为 、
、 ]和浓盐酸制备氯气,进行相关性质实验,并模拟制备“84”消毒液,实验装置如下图所示(夹持仪器已略):
]和浓盐酸制备氯气,进行相关性质实验,并模拟制备“84”消毒液,实验装置如下图所示(夹持仪器已略):
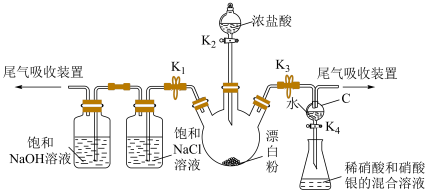
已知: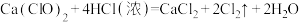
回答下列问题:
(1)A中盛浓盐酸的仪器名称是
(2)验证新制氯水的组成
①关闭 、
、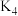 ,打开
,打开 、
、 ,至C中的水变为浅黄绿色时关闭
,至C中的水变为浅黄绿色时关闭 。
。
②取C中溶液,滴加少量紫色石蕊溶液,观察到的现象是
③甲同学打开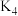 ,将C中溶液放入B中,观察到的现象是
,将C中溶液放入B中,观察到的现象是 溶于水生成
溶于水生成 。乙同学认为甲的结论不正确,乙同学的理由是
。乙同学认为甲的结论不正确,乙同学的理由是
(3)模拟制备“84”消毒液并测定其有效成分的物质的量浓度。操作为关闭
 ,打开
,打开 、
、 ,至E中充满大量黄绿色气体时关闭
,至E中充满大量黄绿色气体时关闭 。写出E中发出反应的离子方程式:
。写出E中发出反应的离子方程式: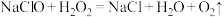 ,再加入足量硝酸酸化的硝酸银溶液,充分反应,过滤、洗涤、干燥、称量,得固体m g,试计算所制“84”消毒液中有效成分的物质的量浓度为
,再加入足量硝酸酸化的硝酸银溶液,充分反应,过滤、洗涤、干燥、称量,得固体m g,试计算所制“84”消毒液中有效成分的物质的量浓度为 (用含“V”和“m”的式子表示)。
(用含“V”和“m”的式子表示)。
您最近一年使用:0次
2024-01-22更新
|
82次组卷
|
2卷引用:辽宁省本溪市第一中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
9 . 二氧化硫是中学化学的重要物质。某化学兴趣小组设计如图实验探究SO2的性质。
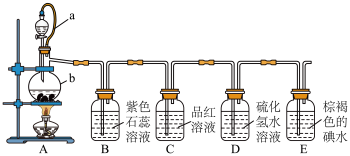
(1)已知b中放入的是纯铜片,写出装置A中的化学方程式_______ 。
(2)同学甲认为该套装置存在一个明显缺陷,其理由是_______ 。
(3)关于该探究实验,下列说法错误的是_______ 。
①装置A中,橡皮管a的作用是使分液漏斗中的液体能顺利流下
②装置B中,紫色溶液变红,证明二氧化硫是酸性氧化物
③装置C中,品红溶液褪色;证明二氧化硫具有漂白性
④装置D中溶液变浑浊,生成了硫单质,证明SO2具有还原性
(4)装置E中溶液褪色,发生的反应离子方程式是_______ 。
(5)实验过程中,同学乙观察到E中溶液在完全褪色后开始逐渐变浑浊。查阅资料后得知,在催化剂的作用下,SO2在水中会发生歧化反应。于是又设计以下实验进行探究(实验中溶液的体积及溶质的物质的量浓度均相同)。
【实验装置】
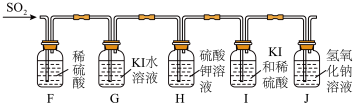
【实验现象】一段时间后,F、H中无明显现象,I中比G中的溶液先变浑浊。
【实验结论】在水中,SO2歧化的离子方程式为_______ 。该反应中的催化剂是_______ (填写序号)。
①H⁺ ②I⁻ ③H⁺、I⁻ ④K⁺、H⁺ ⑤K⁺、I⁻

(1)已知b中放入的是纯铜片,写出装置A中的化学方程式
(2)同学甲认为该套装置存在一个明显缺陷,其理由是
(3)关于该探究实验,下列说法错误的是
①装置A中,橡皮管a的作用是使分液漏斗中的液体能顺利流下
②装置B中,紫色溶液变红,证明二氧化硫是酸性氧化物
③装置C中,品红溶液褪色;证明二氧化硫具有漂白性
④装置D中溶液变浑浊,生成了硫单质,证明SO2具有还原性
(4)装置E中溶液褪色,发生的反应离子方程式是
(5)实验过程中,同学乙观察到E中溶液在完全褪色后开始逐渐变浑浊。查阅资料后得知,在催化剂的作用下,SO2在水中会发生歧化反应。于是又设计以下实验进行探究(实验中溶液的体积及溶质的物质的量浓度均相同)。
【实验装置】

【实验现象】一段时间后,F、H中无明显现象,I中比G中的溶液先变浑浊。
【实验结论】在水中,SO2歧化的离子方程式为
①H⁺ ②I⁻ ③H⁺、I⁻ ④K⁺、H⁺ ⑤K⁺、I⁻
您最近一年使用:0次
10 . 氮是我们熟悉的典型非金属元素,研究它及其化合物的性质对于生产、生活、科研具有重要意义。请回答以下问题:
I.
(1)下图为制取氨气的装置和选用的试剂,其中错误的是___________(填序号)。

II.除去工业尾气中的氮氧化合物( ),常用氨催化吸收法,原理是
),常用氨催化吸收法,原理是 与
与 反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上
反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上 的处理过程。
的处理过程。

模拟尾气处理选用上述部分装置、按下列顺序连接成模拟尾气处理装置,回答有关问题:
 D
D ( )
( ) ( )
( ) ( )
( )
(2)在上述括号中填入选用的装置编号___________ 。
(3)装置A中反应的离子方程式为___________ 。
(4)装置D中的液体可换成___________(填序号)。
(5)装置E中 参加反应的化学方程式为
参加反应的化学方程式为___________ 。
(6)从环保角度分析,该同学所设计的实验存在的明显缺陷是___________ 。
I.
(1)下图为制取氨气的装置和选用的试剂,其中错误的是___________(填序号)。

| A.①② | B.②③ | C.③④ | D.①③ |
II.除去工业尾气中的氮氧化合物(
 ),常用氨催化吸收法,原理是
),常用氨催化吸收法,原理是 与
与 反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上
反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上 的处理过程。
的处理过程。
模拟尾气处理选用上述部分装置、按下列顺序连接成模拟尾气处理装置,回答有关问题:
 D
D ( )
( ) ( )
( ) ( )
( )(2)在上述括号中填入选用的装置编号
(3)装置A中反应的离子方程式为
(4)装置D中的液体可换成___________(填序号)。
A. | B. | C.饱和食盐水 | D.浓硫酸 |
 参加反应的化学方程式为
参加反应的化学方程式为(6)从环保角度分析,该同学所设计的实验存在的明显缺陷是
您最近一年使用:0次
2023-07-13更新
|
79次组卷
|
2卷引用:辽宁省丹东市2022-2023学年高一下学期期末质量监测化学试题



