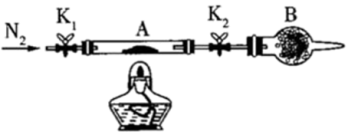
1 . 某兴趣小组欲探究 的性质,并利用
的性质,并利用 制备焦亚硫酸钠(
制备焦亚硫酸钠( )。已知
)。已知 常用作食品抗氧化剂,溶于水即生成
常用作食品抗氧化剂,溶于水即生成 。
。
(1)制取 并探究其性质
并探究其性质
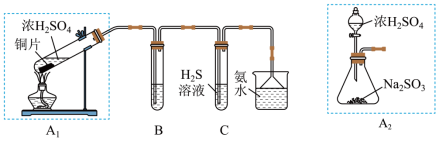
①装置 中发生反应的化学方程式为
中发生反应的化学方程式为_______ 。
②若要利用装置B验证 的还原性,且现象为溶液红色褪去,其中所盛试剂为
的还原性,且现象为溶液红色褪去,其中所盛试剂为_______ (填序号)
A.品红溶液 B.酸性 溶液C.含酚酰的NaOH溶液 D.氯水
溶液C.含酚酰的NaOH溶液 D.氯水
③用足量氨水吸收尾气的离子方程式为_______ 。
④某同学用装置 代替装置
代替装置 ,你认为装置
,你认为装置 除绿色环保外,还具有的优点是
除绿色环保外,还具有的优点是_______ (任写一点)。
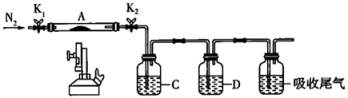
(2)①将 通入
通入 化合制备
化合制备 。某同学推测所得固体产品中含有
。某同学推测所得固体产品中含有 杂质,请设计简单实验证明:
杂质,请设计简单实验证明:_______ 。
②测定某葡萄酒中 残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏;将蒸出的馏分用
残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏;将蒸出的馏分用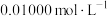 标准
标准 溶液进行滴定(反应为
溶液进行滴定(反应为 ),消耗标准
),消耗标准 溶液25.00mL。计算样品中抗氧化剂的残留量(以
溶液25.00mL。计算样品中抗氧化剂的残留量(以 计)为
计)为_______  。(写出计算过程)
。(写出计算过程)
 的性质,并利用
的性质,并利用 制备焦亚硫酸钠(
制备焦亚硫酸钠( )。已知
)。已知 常用作食品抗氧化剂,溶于水即生成
常用作食品抗氧化剂,溶于水即生成 。
。(1)制取
 并探究其性质
并探究其性质
①装置
 中发生反应的化学方程式为
中发生反应的化学方程式为②若要利用装置B验证
 的还原性,且现象为溶液红色褪去,其中所盛试剂为
的还原性,且现象为溶液红色褪去,其中所盛试剂为A.品红溶液 B.酸性
 溶液C.含酚酰的NaOH溶液 D.氯水
溶液C.含酚酰的NaOH溶液 D.氯水③用足量氨水吸收尾气的离子方程式为
④某同学用装置
 代替装置
代替装置 ,你认为装置
,你认为装置 除绿色环保外,还具有的优点是
除绿色环保外,还具有的优点是(2)①将
 通入
通入 化合制备
化合制备 。某同学推测所得固体产品中含有
。某同学推测所得固体产品中含有 杂质,请设计简单实验证明:
杂质,请设计简单实验证明:②测定某葡萄酒中
 残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏;将蒸出的馏分用
残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏;将蒸出的馏分用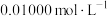 标准
标准 溶液进行滴定(反应为
溶液进行滴定(反应为 ),消耗标准
),消耗标准 溶液25.00mL。计算样品中抗氧化剂的残留量(以
溶液25.00mL。计算样品中抗氧化剂的残留量(以 计)为
计)为 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次
解题方法
2 . 二氧化硫是大气污染物之一,充分了解它的性质具有非常重要的意义。
(1)实验室中用下列装置测定SO2被催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
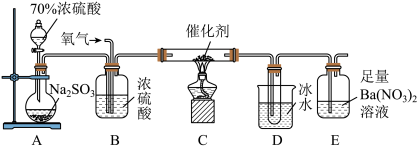
①当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是__________ 。
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是___________ (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图所示装置验证二氧化硫的化学性质。
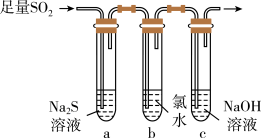
①能说明二氧化硫具有氧化性的实验现象为___________ 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是_____ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________ 。
(1)实验室中用下列装置测定SO2被催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)

①当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
(2)某学习小组设计用如图所示装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
您最近一年使用:0次
2023-12-19更新
|
299次组卷
|
2卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期11月份考试化学试卷
名校
解题方法
3 . 无水FeCl3易潮解,易升华。某化学小组制取无水FeCl3并探究其与SO2的反应,设计如下实验。
I.制备无水FeCl3:

(1)装有MnO2的仪器名称是___________ ,仪器连接顺序为A→___________ (装置可重复使用)。
(2)装置E的作用是___________ 。
(3)整个装置充满黄绿色气体后,才开始加热B装置的目的是___________ 。B中冷水的作用为___________ 。
II.探究与SO2反应:
(4)该小组同学预测
FeCl3与SO2溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式___________ 。
(5)该小组同学向
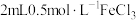 中溶液通入SO2至饱和,观察到溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。
中溶液通入SO2至饱和,观察到溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。
①甲同学认为溶液变红的原因是通入SO2后,Fe3+水解程度增大,形成Fe(OH)3胶体。乙同学根据平衡原理否定了这一推论,理由是___________ 。
②查阅资料:Fe3+能与含+4价S的微粒形成红色配合物。该小组进行如下实验:
根据实验I现象,说明红色物质可能与+4价S的微粒___________ 无关。根据实验I、II现象,说明红色物质主要与___________ 有关。
I.制备无水FeCl3:

(1)装有MnO2的仪器名称是
(2)装置E的作用是
(3)整个装置充满黄绿色气体后,才开始加热B装置的目的是
II.探究与SO2反应:
(4)该小组同学预测
FeCl3与SO2溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式
(5)该小组同学向
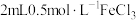 中溶液通入SO2至饱和,观察到溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。
中溶液通入SO2至饱和,观察到溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。①甲同学认为溶液变红的原因是通入SO2后,Fe3+水解程度增大,形成Fe(OH)3胶体。乙同学根据平衡原理否定了这一推论,理由是
②查阅资料:Fe3+能与含+4价S的微粒形成红色配合物。该小组进行如下实验:
| 序号 | 实验 | 加入试剂 | 现象 |
| I |  | 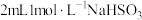 溶液;再滴加足量盐酸 溶液;再滴加足量盐酸 | 溶液变成红色,比(5)中溶液红色深;滴加盐酸后,溶液颜色由红色变成黄色 |
| II | 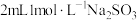 溶液 溶液 | 溶液变成红色,比I中溶液红色深 |
您最近一年使用:0次
2023-09-24更新
|
100次组卷
|
2卷引用:广西柳州市2024届新高三9月摸底考试化学试题
名校
解题方法
4 . 南宁二中“启天化学社”设计如下实验方案制备SO2 (装置图如下),并利用高中所学化学知识探究含硫化合物的相关性质。请回答下列问题:

(1)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是_______ ;加热前,圆底烧瓶中无需加入沸石,其原因是_______ 。
(2)实验室通常使用亚硫酸钠固体与70%硫酸溶液反应制备SO2,此方法与用浓硫酸与铜反应制备SO2相比,优点是:①_______ ,②_______ 。
(3)装置B的作用是_______ ,装置D的作用(请用化学方程式表示)_______ 。
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有二种可能的情况:
I.NaHSO4与NaClO恰好完全反应,此时反应的离子方程式为_______ ;
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
(已知: H2SO3;Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)

(1)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是
(2)实验室通常使用亚硫酸钠固体与70%硫酸溶液反应制备SO2,此方法与用浓硫酸与铜反应制备SO2相比,优点是:①
(3)装置B的作用是
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有二种可能的情况:
I.NaHSO4与NaClO恰好完全反应,此时反应的离子方程式为
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
(已知: H2SO3;Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加入少量CaCO3粉末 | I或II | |
| ② | 滴加少量淀粉-KI溶液,振荡 | 溶液先变蓝后褪色 | |
| ③ | II |
您最近一年使用:0次
名校
解题方法
5 . 人们借助数字传感器可以进行更精准的定量实验研究。利用pH传感器研究CO2、SO2与水的反应,实验装置如图所示。
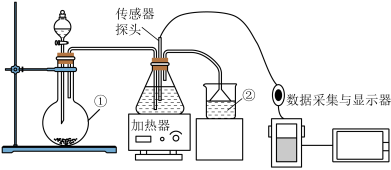
(1)CO2的电子式为___________ 。
(2)装置①的名称为___________ ,装置②中所装液体为___________ 。
(3)写出用以上装置制备SO2的化学方程式___________ 。
(4)通过pH传感器测定CO2和SO2分别溶于水后pH的变化,得到如图1;分别加热两溶液,测得pH随时间变化曲线如图2(已知在30°C101kPa下,CO2溶液度为1.26g/L;SO2溶解度为78g/L。)

①请解释图1中两溶液的pH不同的原因___________ 。
②请结合方程式解释图2中曲线④下降的原因:___________ 。
(5)利用SO2传感器来检测空气中SO2的含量,工作原理如下图所示,该装置的阴极电极反应式为:_________ 。
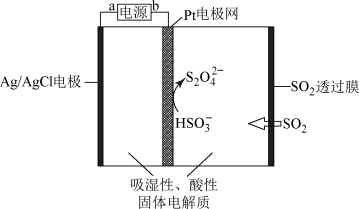
已知SO2穿过透过膜后能完全转化为 。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为___________ g/L。(用含V、a的式子表示) 。

(1)CO2的电子式为
(2)装置①的名称为
(3)写出用以上装置制备SO2的化学方程式
(4)通过pH传感器测定CO2和SO2分别溶于水后pH的变化,得到如图1;分别加热两溶液,测得pH随时间变化曲线如图2(已知在30°C101kPa下,CO2溶液度为1.26g/L;SO2溶解度为78g/L。)

①请解释图1中两溶液的pH不同的原因
②请结合方程式解释图2中曲线④下降的原因:
(5)利用SO2传感器来检测空气中SO2的含量,工作原理如下图所示,该装置的阴极电极反应式为:

已知SO2穿过透过膜后能完全转化为
 。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
您最近一年使用:0次
6 . 硫酸铜主要用作纺织媒染剂、农业杀虫剂、杀真菌剂、防腐剂,还用于皮革鞣制、电镀铜、选矿等。回答下列有关问题:
(1)以印刷线路板的碱性蚀刻废液{主要成分为[Cu(NH3)4]Cl2)为原料制备CuSO4·5H2O晶体。取一定量蚀刻废液和稍过量的NaOH溶液加入如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气;待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体,所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
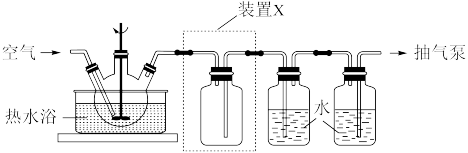
①写出用蚀刻废液制备CuO反应的化学方程式:_______ 。
②检验CuO固体是否洗净的实验操作是_______ 。
③装置图中装置X的作用是_______ 。
④CuSO4溶液加热蒸干得到固体的主要成分是_______ 。
(2)为探究硫酸铜晶体的热稳定性,某学生取少量硫酸铜晶体进行实验,装置如下图所示。

观察到的实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中无色溶液变红色溶液。B中用盐酸酸化的目的是_______ ;C中现象是_______ ;D中有单质参加反应的离子方程式:_______ 。
(3)通过下列方法测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2 +I2=
+I2= +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:_______ 。
(1)以印刷线路板的碱性蚀刻废液{主要成分为[Cu(NH3)4]Cl2)为原料制备CuSO4·5H2O晶体。取一定量蚀刻废液和稍过量的NaOH溶液加入如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气;待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体,所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。

①写出用蚀刻废液制备CuO反应的化学方程式:
②检验CuO固体是否洗净的实验操作是
③装置图中装置X的作用是
④CuSO4溶液加热蒸干得到固体的主要成分是
(2)为探究硫酸铜晶体的热稳定性,某学生取少量硫酸铜晶体进行实验,装置如下图所示。

观察到的实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中无色溶液变红色溶液。B中用盐酸酸化的目的是
(3)通过下列方法测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2
 +I2=
+I2= +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:
您最近一年使用:0次
7 . 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
 | 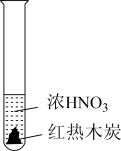 | 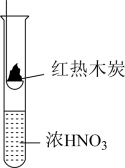 |
| ① | ② | ③ |
| A.由①中的红棕色气体,推断产生的气体一定是混合气体 |
| B.由②中的红棕色气体不能表明木炭与浓硝酸发生了反应 |
| C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 |
| D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
您最近一年使用:0次
2022-06-29更新
|
3749次组卷
|
81卷引用:广西陆川县中学2018届高三12月月考化学试题
广西陆川县中学2018届高三12月月考化学试题广西陆川县中学2018届高三3月月考化学试题2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)河北省衡水中学2018届高三上学期一调考试化学试题山东省淄博第一中学2018届高三上学期开学考试化学试题四川省德阳市三校2018届高三联合测试化学试题北京市清华大学附属中学2018届高三10月月考化学试题北京市一零一中学2018届高三10月月考化学试题云南省峨山彝族自治县第一中学2018届高三上学期期末考试仿真化学试题(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】云南省玉溪市峨山一中2019届高三9月月考化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题百所名校联考-非金属及其化合物内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题四川省绵阳市南山中学2020届高三10月月考化学试题2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(提升练)贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题(已下线)专题3.5 氮及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题北京一零一中2021届高三上学期第三次统练化学试题安徽省滁州市定远县重点中学2021届高三上学期11月质量检测化学试题浙江省诸暨市2021届高三5月适应性考试化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 C 高考挑战区(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第12讲 氮及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)河南部分学校2022届新高三8月份摸底联考化学试题(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题(已下线)考点11 氮及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)第四章 非金属及其化合物 第23讲 硝酸 含氮化合物的转化关系巩固训练12(已下线)题型61 硝酸、硝酸盐的性质(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题(已下线)黄金30题系列 高一化学 小题好拿分【提升版】宁夏银川一中2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题河南省三门峡市2017-2018学年高一上学期期末考试化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题(已下线)2019年12月11日 《每日一题》化学人教版(必修1)——硝酸的强氧化性福建省福州市第一中学2020年高一在线自测自评质检化学试题安徽省池州市第一中学2019-2020学年高一下学期期中教学质量检测化学试题云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题2019年上海市高中生化学竞赛初赛试题(“华理一化工杯”)初赛试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第3章 第3节 氮的循环 高考帮(已下线)【浙江新东方】48(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】陕西省西安市长安区第一中学2019-2020学年高一上学期期末考试化学试题专题7 第一~二单元 综合拔高练-高中化学必修第二册苏教版2019(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物(已下线)【浙江新东方】高中化学20210304-015黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题福建省泉州科技中学2020-2021学年高一下学期期中考试化学试题安徽省芜湖市2020-2021学年高一下学期期末质量检测联考化学试题北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题课后-5.2.3 硝酸 酸雨及防治-人教2019必修第二册辽宁省沈阳市第二十中学2019-2020学年高一下学期第一次月考化学试题江西省吉安市2021-2022学年高二下学期期末检测化学试题广东省揭阳华侨高级中学2021-2022学年高一下学期第一次阶段化学试题北京市首师附密云中学2021-2022学年高一下学期等级考化学试题山东省菏泽市单县第二中学2021-2022学年高一上学期(实验班)12月段考化学试题安徽省合肥市第一中学2022-2023学年高一下学期第4次月考化学试题
8 . 工业和居民生活向大气排放污染物使大气酸化,造成大气酸化的主要气体之一是SO2.某化学学习小组同学对SO2性质进行了探究。
(1)学习小组用图1装置制备SO2气体。_______ 。
②写出仪器A中发生反应的化学方程式_______ 。
③反应结束后,排除A瓶中残留的SO2气体,其具体操作是_______ 。
(2)学习小组用图2装置来检验SO2的性质,回答有关问题。
①甲同学欲检验SO2的漂白性,则B中应加入的试剂是_______ 。
②乙同学欲检验SO2的氧化性和还原性,分别在B、C中盛放Na2S溶液、FeCl3溶液,请描述在通入SO2气体过程中观察到的现象_______ 。
③丙同学欲检验H2SO3与HClO酸性强弱,应分别在B、C中盛放_______ (填标号)。
A.足量Ca (ClO)2溶液、Ba (OH)2溶液 B.足量NaClO、澄清石灰水
C.足量NaHCO3、NaClO溶液 D.足量NaHCO3、Ca (ClO)2溶液
(3)学习小组对Na2SO3固体的纯度进行了测定,取15. 0g Na2SO3固体样品配置成100 mL溶液,取25. 00mL放入锥形瓶中,加水稀释到50 mL,然后用1. 000 mol·L-1酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液10. 00mL。
①滴定终点的判断依据是_______ 。
②Na2SO3固体的纯度为_______ 。
(1)学习小组用图1装置制备SO2气体。

②写出仪器A中发生反应的化学方程式
③反应结束后,排除A瓶中残留的SO2气体,其具体操作是
(2)学习小组用图2装置来检验SO2的性质,回答有关问题。
①甲同学欲检验SO2的漂白性,则B中应加入的试剂是
②乙同学欲检验SO2的氧化性和还原性,分别在B、C中盛放Na2S溶液、FeCl3溶液,请描述在通入SO2气体过程中观察到的现象
③丙同学欲检验H2SO3与HClO酸性强弱,应分别在B、C中盛放
A.足量Ca (ClO)2溶液、Ba (OH)2溶液 B.足量NaClO、澄清石灰水
C.足量NaHCO3、NaClO溶液 D.足量NaHCO3、Ca (ClO)2溶液
(3)学习小组对Na2SO3固体的纯度进行了测定,取15. 0g Na2SO3固体样品配置成100 mL溶液,取25. 00mL放入锥形瓶中,加水稀释到50 mL,然后用1. 000 mol·L-1酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液10. 00mL。
①滴定终点的判断依据是
②Na2SO3固体的纯度为
您最近一年使用:0次
2022-05-24更新
|
1136次组卷
|
3卷引用:广西2022届高三第一次适应性测试理科综合化学试题
解题方法
9 . 绿矾(FeSO4·xH2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视;绿矾焙烧是一种生产硫酸的古老方法。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,若产生___________ 现象,说明该样品已变质。
(2)为测定绿矾中结晶水含量,将石英玻璃管A(带两端开关K1和K2)称重,质量为150.0g,将样品装入石英玻璃管中,再次将装置A称重,质量为177.7g。按如图所示连接好装置进行实验,A中发生的反应为:FeSO4·xH2O FeSO4+xH2O↑。
FeSO4+xH2O↑。
①仪器B的名称是___________ 。
②下列实验操作步骤,正确的顺序为da___________ e;重复上述操作步骤,直至装置A恒重,质量为165.2g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=___________ (结果保留到小数点后一位)。
(3)为探究硫酸亚铁高温分解的产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
①加热前通入N2的作用是___________ 。
②C中盛有BaCl2溶液,观察到C中有白色沉淀生成,则该沉淀是___________ (填化学式)。
③D中所盛的试剂为品红溶液,观察到溶液褪色。根据上述实验现象,写出硫酸亚铁高温分解的化学反应方程式:___________ 。
(4)绿矾的纯度可通过KMnO4滴定法测定。现称取2.780g绿矾样品,配制成250mL溶液,用硫酸酸化的0.0100mol·L-1的KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
①此滴定实验达到终点的现象是___________ 。
②上表中第一次实验记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.第一次滴定前酸式滴定管尖嘴有气泡,滴定结束无气泡
B.第一次滴定用的锥形瓶用待测液润洗过
C.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积
D.后两次滴定所用酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,若产生
(2)为测定绿矾中结晶水含量,将石英玻璃管A(带两端开关K1和K2)称重,质量为150.0g,将样品装入石英玻璃管中,再次将装置A称重,质量为177.7g。按如图所示连接好装置进行实验,A中发生的反应为:FeSO4·xH2O
 FeSO4+xH2O↑。
FeSO4+xH2O↑。
①仪器B的名称是
②下列实验操作步骤,正确的顺序为da
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁高温分解的产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①加热前通入N2的作用是
②C中盛有BaCl2溶液,观察到C中有白色沉淀生成,则该沉淀是
③D中所盛的试剂为品红溶液,观察到溶液褪色。根据上述实验现象,写出硫酸亚铁高温分解的化学反应方程式:
(4)绿矾的纯度可通过KMnO4滴定法测定。现称取2.780g绿矾样品,配制成250mL溶液,用硫酸酸化的0.0100mol·L-1的KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 24.52 | 24.02 | 23.98 |
②上表中第一次实验记录数据明显大于后两次,其原因可能是
A.第一次滴定前酸式滴定管尖嘴有气泡,滴定结束无气泡
B.第一次滴定用的锥形瓶用待测液润洗过
C.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积
D.后两次滴定所用酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
您最近一年使用:0次
名校
10 . “绿色化学”走进课堂,某学习小组在老师的指导下,设计了“氯气与金属钠反应”的实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大小的金属钠(已吸净煤油),玻璃管尾部塞一团浸有 溶液的棉花球。先给钠预热,到钠熔化成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
溶液的棉花球。先给钠预热,到钠熔化成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
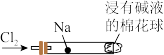
 溶液的棉花球。先给钠预热,到钠熔化成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
溶液的棉花球。先给钠预热,到钠熔化成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是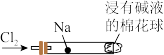
A.浸有 溶液的棉球主要用于防止空气中二氧化碳进来与钠反应 溶液的棉球主要用于防止空气中二氧化碳进来与钠反应 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.从实验现象上判断钠的熔点较低 |
| D.钠有很强的还原性,本质原因是钠原子的最外层只有1个电子,该电子很容易失去 |
您最近一年使用:0次
2021-09-16更新
|
1442次组卷
|
11卷引用:广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题
广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题浙江省宁波市镇海中学2020-2021学年高一上学期期末考试化学试卷山东省滨州邹平市黄山中学2021-2022学年高一上学期第一次月考化学试题重庆市育才中学校2021-2022学年高一上学期期中考试化学试题 广东省汕头市澄海中学2021-2022学年高一上学期期中考试化学试题湖南省衡阳市2021-2022学年高一上学期期末质量检测化学试题(已下线)2.2.2 氯气与金属、非金属及还原性化合物的反应-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)广东省广州市第二中学教育集团2022-2023学年高一上学期期中考试化学试题湖北省荆州中学2022-2023学年高一上学期期末考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元03巩固练江西省赣州市信丰中学2023-2024学年高一上学期第四次月考化学试题



