名校
解题方法
1 . 下列各组实验中,实验操作、现象及结论或解释均正确的是
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| B | 在干冰中央挖一个小穴,撒一些镁粉,用红热的铁棒把镁引燃,盖上另一块干冰 | 镁粉在干冰中继续燃烧,发出耀眼的白光 | CO2不能扑灭金属镁引起的火灾 |
| C | 向K2S溶液中通入足量的CO2,然后将产生的气体导入CuSO4溶液中 | CuSO4溶液中产生黑色沉淀 | Ka1(H2S)>Ka1(H2CO3) |
| D | 向蔗糖中加入适量浓硫酸,搅拌 | 产生黑色“面包” | 浓硫酸具有酸性和吸水性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
134次组卷
|
2卷引用:广东省深圳市光明区高级中学2023-2024学年高三下学期5月模拟考试化学试题
名校
2 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
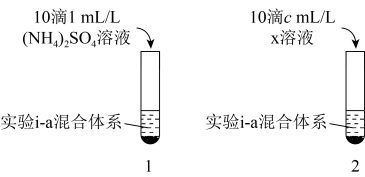
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是___________ ,c=___________ 。___________ 。
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:___________ ;反应的离子方程式为:___________ 。
| 实验序号 | 操作 | 现象 | |
| 实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
| 实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:
您最近一年使用:0次
解题方法
3 .  用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。
 .配制溶液
.配制溶液
(1)配制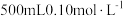 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为___________  。
。
(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有___________ (填标号)。 .实验探究
.实验探究
探究温度对 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。
(3) 溶液显碱性的原因是
溶液显碱性的原因是___________ (用离子方程式表示)。
(4)实验1中测得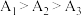 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中___________ 发挥主导作用。实验1中测得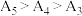 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。
(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料: 溶液中存在平衡:
溶液中存在平衡: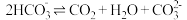 。
。
提出猜想:对于 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。
实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
实验结论:②根据实验1~3的结果,小组同学认为猜想成立,其判断依据是___________ 。
拓展总结:③ 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: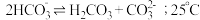 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为___________ [保留两位有效数字;已知: 时,
时,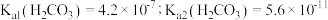 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。
(6)写出 在生产或生活中的一种应用
在生产或生活中的一种应用___________ 。
 用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。 .配制溶液
.配制溶液(1)配制
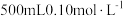 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为 。
。(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有
 .实验探究
.实验探究探究温度对
 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。| 实验序号 | 操作 | 测试温度 |  |
| 1 | 采用水浴加热,将 溶液从 溶液从 持续升温至 持续升温至 ,每隔 ,每隔 测量并记录溶液 测量并记录溶液 |  |  |
 |  | ||
 |  | ||
 |  | ||
 | 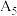 |
(3)
 溶液显碱性的原因是
溶液显碱性的原因是(4)实验1中测得
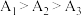 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中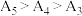 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料:
 溶液中存在平衡:
溶液中存在平衡: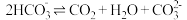 。
。提出猜想:对于
 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
| 实验序号 | 操作 | 测试温度 |  |
| 2 | 采用水浴加热,① ,并记录溶液 ,并记录溶液 |  |  |
| 3 | 采用水浴加热,将 溶液从 溶液从 升温至 升温至 ,然后冷却至 ,然后冷却至 ,并记录溶液 ,并记录溶液 |  |  |
拓展总结:③
 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: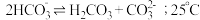 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为 时,
时,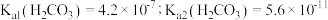 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。(6)写出
 在生产或生活中的一种应用
在生产或生活中的一种应用
您最近一年使用:0次
名校
解题方法
4 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
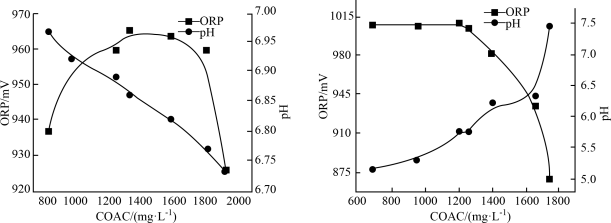
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
5 . 某研究性学习小组探究硫的化合物的制备和性质。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。 气体最合适的发生装置是
气体最合适的发生装置是___________ (填写字母)。
Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理: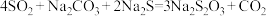
室温时,往 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入 气体。
气体。
(2)制备 反应分三步进行
反应分三步进行
反应i: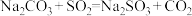 ;
;
反应ii: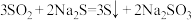 ;
;
反应iii的化学方程式为___________ 。
(3)当pH值接近于7时,停止通入 的原因是
的原因是___________ 。
Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将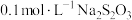 溶液、
溶液、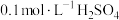 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
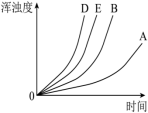
通过实验绘制出的浑浊度随时间变化关系如图所示:
___________ (实验标号)探究H2SO4溶液浓度对反应速率的影响。
②请在图中画出实验 对应的曲线
对应的曲线___________ 。
Ⅳ.探究性质
资料:
(5) 在酸性溶液中氧化I-,反应为:
在酸性溶液中氧化I-,反应为:___________ 。
向某浓度的过量 酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
某实验小组提出假设:t秒前生成了 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,是由于
反应,且该反应速率较快,故溶液没有立刻变蓝,是由于 与
与 反应SO2+I2+2H2O=2I—+SO
反应SO2+I2+2H2O=2I—+SO +4H+
+4H+
(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中___________ ;可观察到现象为:蓝色迅速消失,一段时间后再次变蓝。
应用:写出一个SO2相关性质在日常生活生产中的用途___________ 。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。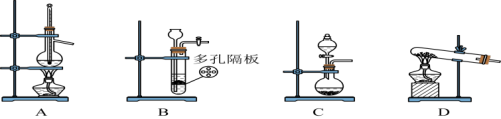
 气体最合适的发生装置是
气体最合适的发生装置是Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理:
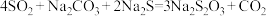
室温时,往
 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入 气体。
气体。(2)制备
 反应分三步进行
反应分三步进行反应i:
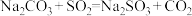 ;
;反应ii:
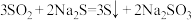 ;
;反应iii的化学方程式为
(3)当pH值接近于7时,停止通入
 的原因是
的原因是Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将
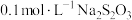 溶液、
溶液、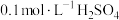 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。| 实验标号 | 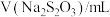 | 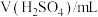 | V(蒸馏水)/mL |
| A | 1.5 | 3.5 | 10 |
| B | 2.5 | 3.5 | 9 |
| C | 3.5 | 3.5 | 8 |
| D | 3.5 | 2.5 | 9 |
| E | 3.5 | 1.5 | 10 |
②请在图中画出实验
 对应的曲线
对应的曲线Ⅳ.探究性质
资料:
(5)
 在酸性溶液中氧化I-,反应为:
在酸性溶液中氧化I-,反应为:向某浓度的过量
 酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。某实验小组提出假设:t秒前生成了
 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,是由于
反应,且该反应速率较快,故溶液没有立刻变蓝,是由于 与
与 反应SO2+I2+2H2O=2I—+SO
反应SO2+I2+2H2O=2I—+SO +4H+
+4H+(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中
应用:写出一个SO2相关性质在日常生活生产中的用途
您最近一年使用:0次
名校
6 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4___________ 。
(2)装置长颈漏斗的作用___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________ 。
Ⅰ.实验室制备N2H4

(2)装置长颈漏斗的作用
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
名校
解题方法
7 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
8 . 按图装置进行实验。将浓硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法不正确的是
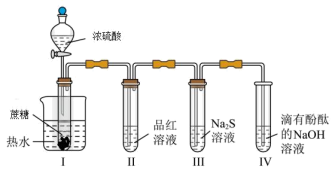
| A.Ⅰ中试管内有“黑面包”生成,说明浓硫酸体现了吸水性 |
| B.Ⅱ中品红溶液褪色,说明在Ⅰ中浓硫酸还体现了强氧化性 |
C.Ⅲ中的溶液一段时间后才会变浑浊,说明 有氧化性 有氧化性 |
| D.撤掉水浴,重做实验,Ⅳ中红色褪去变慢 |
您最近一年使用:0次
解题方法
9 . 二氧化硫是一种使人们爱恨交加的物质,爱其作为一种化工原料,为人类提供物质基础,恨其有毒,对人类即环境的危害。联系工业生产中用碱液吸收含 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: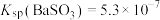 。
。
(1)利用85%的浓硫酸和 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。
(2) 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。
某同学查阅资料:常温时, ,
,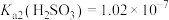 。
。
某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是________ (填微粒化学式)。
(3)“性质实验装置”中将 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀:________________ ;有同学结合“性质实验”反应物的组成及性质推断该沉淀为 ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是________________ 。请你设计实验探究该反应的生成物是 ,而不是
,而不是 :
:________________ 。
(4)在“性质实验装置”中制备少量硫代硫酸钠( ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为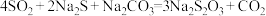 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中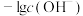 、
、 的质量变化关系如下图:
的质量变化关系如下图: 的生成量曲线为
的生成量曲线为________ (填“甲”或“乙”),曲线乙Q点后出现急剧下降的原因是________ 。
(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用________ 。
 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: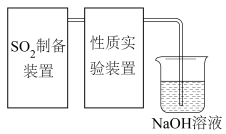
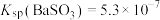 。
。(1)利用85%的浓硫酸和
 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。A.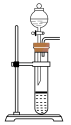 | B. | C.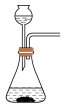 | D.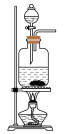 |
(2)
 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。某同学查阅资料:常温时,
 ,
,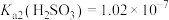 。
。某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的
 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是(3)“性质实验装置”中将
 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀: ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是 ,而不是
,而不是 :
:(4)在“性质实验装置”中制备少量硫代硫酸钠(
 ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为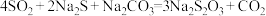 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中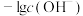 、
、 的质量变化关系如下图:
的质量变化关系如下图:
 的生成量曲线为
的生成量曲线为(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用
您最近一年使用:0次
10 . 按照下图进行铜与浓硫酸反应的探究实验,下列说法正确的是
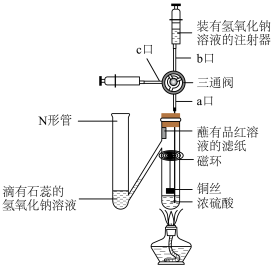
A.蘸有品红溶液的滤纸褪色,说明 具有强氧化性 具有强氧化性 |
| B.N形管溶液变为红色,说明有酸性气体进入N形管 |
| C.反应后,从c口抽取反应液加到足量的氨水中最终产生蓝色沉淀 |
| D.实验结束后从b口注入足量NaOH溶液,会有2种物质与NaOH反应 |
您最近一年使用:0次




