解题方法
1 . 实验小组对Mg与NH4Cl溶液的反应进行探究。
(1)用pH计测定1.0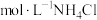 溶液约为4.6,分析NH4Cl溶液呈酸性的原因
溶液约为4.6,分析NH4Cl溶液呈酸性的原因______ (用化学用语表示)。
(2)探究镁与NH4Cl溶液的反应:实验Ⅰ、Ⅱ所取镁粉质量均为0.5g,分别加入选取的实验试剂中。
①实验Ⅰ中发生反应的化学方程式为______ 。
②经检验实验Ⅱ中刺激性气味气体为NH3和H2的混合气体,用平衡移动原理解释产生NH3的原因______ 。
③已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有______ ,灰白色固体可能是______ (填化学式)。
④针对实验Ⅱ比实验Ⅰ反应剧烈的原因,小组同学提出了两种假设:
假设l:NH4Cl溶液中的H+溶解了Mg(OH)2;
假设2:NH4Cl溶液中的 溶解了Mg(OH)2。
溶解了Mg(OH)2。
为证明假设的合理性.小组同学做了如下对比实验:
实验结论是______ 。
(3)甲同学通过深入思考,认为Mg与NH4Cl溶液反应剧烈.可能还与 有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为
有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为______ 。
(4)由上述实验得出的结论是______ 。
(1)用pH计测定1.0
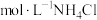 溶液约为4.6,分析NH4Cl溶液呈酸性的原因
溶液约为4.6,分析NH4Cl溶液呈酸性的原因(2)探究镁与NH4Cl溶液的反应:实验Ⅰ、Ⅱ所取镁粉质量均为0.5g,分别加入选取的实验试剂中。
实验 | 实验试剂 | 实验现象 |
Ⅰ | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
Ⅱ | 5mL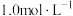 NH4Cl溶液(pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
②经检验实验Ⅱ中刺激性气味气体为NH3和H2的混合气体,用平衡移动原理解释产生NH3的原因
③已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有
④针对实验Ⅱ比实验Ⅰ反应剧烈的原因,小组同学提出了两种假设:
假设l:NH4Cl溶液中的H+溶解了Mg(OH)2;
假设2:NH4Cl溶液中的
 溶解了Mg(OH)2。
溶解了Mg(OH)2。为证明假设的合理性.小组同学做了如下对比实验:
实验 | 实验方案 | 实验现象 |
Ⅲ | 取2根覆盖了Mg(OH)2的Mg条,分别同时放入相同体积相同pH的盐酸和饱和NH4Cl溶液中。 | 饱和NH4Cl溶液中反应更剧烈。 |
Ⅳ | 向饱和NH4Cl溶液中滴加浓氨水,使溶液呈中性或略显碱性,再放入覆盖了Mg(OH)2的镁条。 | 剧烈反应,但是比实验Ⅲ饱和NH4Cl溶液略慢,产生刺激性气味气体和灰白色难溶固体。 |
(3)甲同学通过深入思考,认为Mg与NH4Cl溶液反应剧烈.可能还与
 有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为
有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为(4)由上述实验得出的结论是
您最近一年使用:0次
2024-01-24更新
|
85次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
2 . 实验小组用如图装置探究 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。 遇淀粉溶液变蓝
遇淀粉溶液变蓝
实验过程:
Ⅰ.打开弹簧夹 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;
Ⅱ.打开活塞 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;
Ⅲ.当 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;
Ⅳ.打开活塞 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。
(1) 中发生反应的化学方程式是
中发生反应的化学方程式是______ 。
(2)浸有 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是______ 。
(3) 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是______ 。
(4)为探究 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的部分 微粒,结果如表所示(忽略空气中 的影响)。
的影响)。
①检验 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是______ 。
②进一步检验 的实验操作及现象是
的实验操作及现象是______ 。
③能证明该实验条件下氧化性 的有
的有______ (填“甲”“乙”或“丙”)。不能证明的请说明理由:______ 。
 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。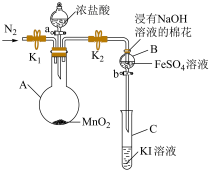
 遇淀粉溶液变蓝
遇淀粉溶液变蓝实验过程:
Ⅰ.打开弹簧夹
 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;Ⅱ.打开活塞
 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;Ⅲ.当
 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;Ⅳ.打开活塞
 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。(1)
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)浸有
 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是(3)
 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是(4)为探究
 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的 的影响)。
的影响)。
|
| |
甲 | 既有 | 有 |
乙 | 有 | 有 |
丙 | 有 | 有 |
 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是②进一步检验
 的实验操作及现象是
的实验操作及现象是③能证明该实验条件下氧化性
 的有
的有
您最近一年使用:0次
2024-01-20更新
|
150次组卷
|
2卷引用:北京市西城区2023-2024学年高一上学期期末考试化学试卷
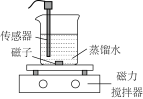
3 . 常温下,某小组同学用如下实验探究 的沉淀溶解平衡
的沉淀溶解平衡
已知:酚酞的变色范围:pH<8.2无色;8.2≤pH≤10.0粉红色;pH>10红色
下列说法不正确 的是
 的沉淀溶解平衡
的沉淀溶解平衡实验装置 |
| |
实验序号 | Ⅰ | Ⅱ |
| 传感器种类 | 导电率传感器 | pH传感器 |
| 实验操作 | 向蒸馏水中加入足量的 粉末,一段时间后再加蒸馏水 粉末,一段时间后再加蒸馏水 | 向滴有酚酞的蒸馏水中加入 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 |
| 实验数据 |  | 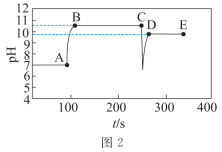 |
下列说法
A.图1中a点导电率不为0的原因是: |
B.图1中d点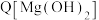 小于 小于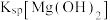 |
| C.实验Ⅱ中,溶液颜色先变红,后变为无色,最后溶液呈粉红色 |
D.实验Ⅱ中:加入 的物质的量小于加入硫酸的物质的量 的物质的量小于加入硫酸的物质的量 |
您最近一年使用:0次
2024-01-20更新
|
76次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
4 . 某化学小组以铜为阳极、石墨为阴极,研究在不同的电解质溶液中铜被氧化的价态及产物。实验装置如图所示(电源装置略去)。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
(1)I中铜电极的电极反应式是___________ 。
(2)II中沉淀由黄色变为砖红色的化学方程式是___________ 。
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是___________ 。
②步骤iii的操作是___________ 。
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,___________ ,CuOH不稳定易分解为砖红色的Cu2O。
(5)IV中Cu未被氧化的原因是________ 。
(6)综上,铜被氧化的价态及产物与________ 有关。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
| 实验 | 电解质溶液(3 mol/L) | 现象 | |
| 铜电极附近 | 石墨电极 | ||
| I | H2SO4 | 溶液变蓝 | 产生无色气泡,一段时间后有少量红色金属析出 |
| II | NaOH | 出现黄色浑浊,很快变为砖红色 | 产生无色气泡 |
| III | NaCl | 出现白色浑浊,浑浊向下扩散,一段时间后,下端白色沉淀变黄,最终为砖红色 | 产生无色气泡 |
| IV | KI | 迅速产生棕褐色的物质,滴入1 滴淀粉溶液, 立即变为蓝色;取出铜电极洗净检验,无变化 | 产生无色气泡 |
(2)II中沉淀由黄色变为砖红色的化学方程式是
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是
②步骤iii的操作是
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,
(5)IV中Cu未被氧化的原因是
(6)综上,铜被氧化的价态及产物与
您最近一年使用:0次
名校
解题方法
5 . 下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是
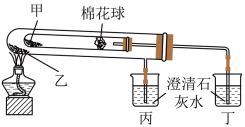
| A.Na2CO3热稳定性大于NaHCO3 |
| B.甲为Na2CO3,乙为NaHCO3 |
| C.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末的棉花球 |
| D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊 |
您最近一年使用:0次
2024-01-16更新
|
105次组卷
|
4卷引用:河北省石家庄市第一中学西校区2023-2024高一上学期期末考试化学试题
名校
解题方法
6 . 某实验小组欲探究 和
和 能否发生反应,设计如下图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
能否发生反应,设计如下图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
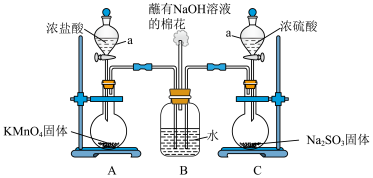
(1)装置C中反应的化学方程式_______ 。
(2)装置A中的反应为_______ _______
_______ (浓)=_______
(浓)=_______ _______
_______ _______
_______ _______
_______ 。
。
①配平该反应并用单线桥表示电子转移_______ 。
②反应中的氧化剂和还原剂的物质的量之比是_______ ,生成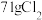 转移的电子是
转移的电子是_______  。
。
(3)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验甲同学取适量B中溶液于试管中,向其中滴加一滴 
稀溶液 ,即有白色沉淀生成。
①甲同学由此认为 和
和 发生了反应,理由是该反应中生成了
发生了反应,理由是该反应中生成了_______ 离子(写离子符号)。
②乙认为甲的结论不合理,认为A中生成的 中混有杂质,乙认为混有的杂质是
中混有杂质,乙认为混有的杂质是_______ ;
③丙认为白色沉淀不能证明 和
和 发生反应,因氯气的水溶液加
发生反应,因氯气的水溶液加 溶液也有白色沉淀产生,可改为取B中溶液于试管中滴加X,有白色沉淀生成即可证明,X是
溶液也有白色沉淀产生,可改为取B中溶液于试管中滴加X,有白色沉淀生成即可证明,X是_______ (填编号)
a. 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液 d.品红溶液
溶液 d.品红溶液
(4) 与
与 同时通入水中反应的离子方程式
同时通入水中反应的离子方程式_______ 。
 和
和 能否发生反应,设计如下图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
能否发生反应,设计如下图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
(1)装置C中反应的化学方程式
(2)装置A中的反应为_______
 _______
_______ (浓)=_______
(浓)=_______ _______
_______ _______
_______ _______
_______ 。
。①配平该反应并用单线桥表示电子转移
②反应中的氧化剂和还原剂的物质的量之比是
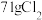 转移的电子是
转移的电子是 。
。(3)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验甲同学取适量B中溶液于试管中,向其中滴加

①甲同学由此认为
 和
和 发生了反应,理由是该反应中生成了
发生了反应,理由是该反应中生成了②乙认为甲的结论不合理,认为A中生成的
 中混有杂质,乙认为混有的杂质是
中混有杂质,乙认为混有的杂质是③丙认为白色沉淀不能证明
 和
和 发生反应,因氯气的水溶液加
发生反应,因氯气的水溶液加 溶液也有白色沉淀产生,可改为取B中溶液于试管中滴加X,有白色沉淀生成即可证明,X是
溶液也有白色沉淀产生,可改为取B中溶液于试管中滴加X,有白色沉淀生成即可证明,X是a.
 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液 d.品红溶液
溶液 d.品红溶液(4)
 与
与 同时通入水中反应的离子方程式
同时通入水中反应的离子方程式
您最近一年使用:0次
2024-01-15更新
|
256次组卷
|
2卷引用:上海市上海中学2023-2024学年高一上学期期末考试化学试卷
名校
解题方法
7 . 以海水为原料可获得钠、镁等金属及其化合物。
(1)将金属钠分别放入下列溶液中,既有气体产生,又有沉淀产生的是_____ (填序号,下同)
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④CuSO4溶液 ⑤饱和石灰水
溶液 ④CuSO4溶液 ⑤饱和石灰水
(2)某实验小组通过如图所示实验,探究 与水的反应,下列说法正确的是_____。
与水的反应,下列说法正确的是_____。

(3)某膨松剂中发挥作用的物质为碳酸氢钠,学校兴趣小组为研究该膨松剂在加热情况下放出气体的量,设计了如图所示实验(装置A、C、D、E中的试剂足量)。
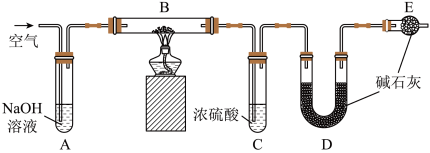
①加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用_______ ,停止加热后,还需继续通入一段时间的空气,目的是_______ 。
②将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为___________ ;样品产生的二氧化碳的质量可通过测定实验前后装置_____ (填装置对应的标号)的质量测得。
③若没有装置E,可能会造成测定结果_______ (填“偏大”、“偏小”或“不变”)。
④实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为______ L,膨松剂样品中所含碳酸氢钠的物质的量为_____ mol。
(1)将金属钠分别放入下列溶液中,既有气体产生,又有沉淀产生的是
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④CuSO4溶液 ⑤饱和石灰水
溶液 ④CuSO4溶液 ⑤饱和石灰水(2)某实验小组通过如图所示实验,探究
 与水的反应,下列说法正确的是_____。
与水的反应,下列说法正确的是_____。
| A.②中的大量气泡主要成分是氢气 |
| B.③中溶液变红,说明有酸性物质生成 |
| C.④中现象可能是由于溶液中含有强氧化性物质造成的 |
D.⑤中 的主要作用是降低了水中氧气的溶解度 的主要作用是降低了水中氧气的溶解度 |
(3)某膨松剂中发挥作用的物质为碳酸氢钠,学校兴趣小组为研究该膨松剂在加热情况下放出气体的量,设计了如图所示实验(装置A、C、D、E中的试剂足量)。

①加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用
②将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为
③若没有装置E,可能会造成测定结果
④实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
8 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到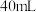 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到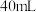 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是 大 大 |
D.向①中褪色后的溶液中滴加5滴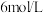 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
116次组卷
|
21卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市海淀区2021届高三上学期期中考试化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题天津市第一中学2023-2024学年高一上学期11月期中化学试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题北京市第一五九中学2023-2024学年高一上学期期中考试化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题
名校
9 . 铁是生产、生活及生命中的重要元素。回答下列问题:
(1)铁在元素周期表中的位置为______ 。
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。
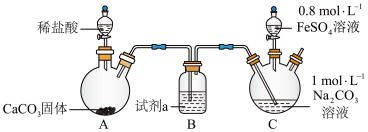
向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为______ 。
②向碳酸钠溶液中通入CO2的目的有______ 、______ 。
③试剂a是______ ,装置C中制取FeCO3的离子方程式为______ 。
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
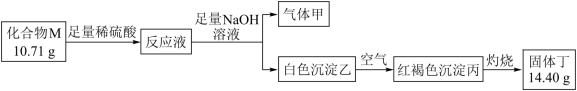
气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式______ 。
(1)铁在元素周期表中的位置为
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。

向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为
②向碳酸钠溶液中通入CO2的目的有
③试剂a是
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式
您最近一年使用:0次
2023-12-14更新
|
479次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一上学期1月期末化学试题
10 . 氯化铁(FeCl3)是一种易潮解、易升华的无机化工产品。某同学在实验室制备氯气(Cl2),并用干燥纯净的氯气与 反应制备
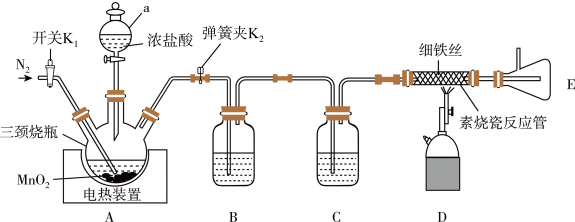
反应制备 ,装置如图所示(部分夹持仪器已省略):
,装置如图所示(部分夹持仪器已省略):
回答下列问题:
(1)仪器a的名称是___________ ,装置B、C装的试剂分别是___________ 、___________ 。
(2)写出三颈烧瓶中反应的离子方程式___________ 。
(3)实验开始前需要通入一段时间N2,其目的是___________ 。
(4)该装置存在的不足之处是___________ ,改进方法中需要用到的试剂为___________ 。
A.浓硫酸 B.无水CaCl2 C.无水硫酸铜 D.碱石灰
 反应制备
反应制备 ,装置如图所示(部分夹持仪器已省略):
,装置如图所示(部分夹持仪器已省略):
回答下列问题:
(1)仪器a的名称是
(2)写出三颈烧瓶中反应的离子方程式
(3)实验开始前需要通入一段时间N2,其目的是
(4)该装置存在的不足之处是
A.浓硫酸 B.无水CaCl2 C.无水硫酸铜 D.碱石灰
您最近一年使用:0次
2023-12-12更新
|
276次组卷
|
2卷引用:河南省周口市鹿邑县2023-2024学年高一上学期1月期末化学试题