名校
1 . I、现有一份含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。(可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水。)回答下列问题:
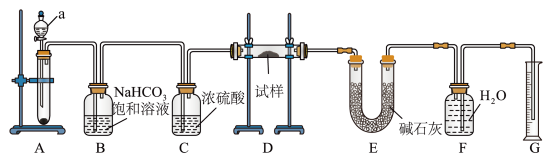
(1)装置a的名称为_______ 。
(2)装置B的作用:_______ 。
(3)装置D中生成O2的反应的化学方程式为_______ 。
(4)装置E中的碱石灰的主要作用是_______ ;若撤掉装置E,会使测得的Na2O2的含量_______ (选填“偏高”,“偏低”,“无影响”)。
(5)已知装置D中试样质量为15.6g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数_______ 。
Ⅱ、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为_______ 。
A.先通CO2再通NH3 B.先通NH3再通CO2

(1)装置a的名称为
(2)装置B的作用:
(3)装置D中生成O2的反应的化学方程式为
(4)装置E中的碱石灰的主要作用是
(5)已知装置D中试样质量为15.6g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数
Ⅱ、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为
A.先通CO2再通NH3 B.先通NH3再通CO2
您最近一年使用:0次
名校
2 . 某同学查阅资料得知,无水三氯化铝能催化乙醇制备乙烯,为探究适宜的反应温度,设计如下反应装置:

检验装置气密性后,在圆底烧瓶中加入5 g无水三氯化铝,加热至100℃,通过A加入10 mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)仪器B的名称是______ ;该实验所采用的加热方式优点是______ ,液体X可能是______ (选填编号)。
a.水 b.酒精 c.油 d.乙酸
(2)根据实验结果,判断适宜的反应温度为______ 。
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色可能的原因是____________________ 。
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是____________________ 。
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有______ (列举一点)。
工业无水氯化铝含量测定的主要原理是: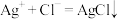 。将1.400 g工业无水氯化铝样品溶解后配成500 mL溶液,量取25.00 mL置于锥形瓶中,用浓度为
。将1.400 g工业无水氯化铝样品溶解后配成500 mL溶液,量取25.00 mL置于锥形瓶中,用浓度为 的AgNO3标准溶液进行滴定,达到终点时消耗标准液13.35 mL。(已知:AlCl3的相对分子质量为133.5)
的AgNO3标准溶液进行滴定,达到终点时消耗标准液13.35 mL。(已知:AlCl3的相对分子质量为133.5)
(6)该样品中AlCl3的质量分数为______ (保留3位有效数字)。
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是______ (选填编号)。
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质

检验装置气密性后,在圆底烧瓶中加入5 g无水三氯化铝,加热至100℃,通过A加入10 mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)仪器B的名称是
a.水 b.酒精 c.油 d.乙酸
(2)根据实验结果,判断适宜的反应温度为
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色可能的原因是
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有
工业无水氯化铝含量测定的主要原理是:
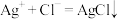 。将1.400 g工业无水氯化铝样品溶解后配成500 mL溶液,量取25.00 mL置于锥形瓶中,用浓度为
。将1.400 g工业无水氯化铝样品溶解后配成500 mL溶液,量取25.00 mL置于锥形瓶中,用浓度为 的AgNO3标准溶液进行滴定,达到终点时消耗标准液13.35 mL。(已知:AlCl3的相对分子质量为133.5)
的AgNO3标准溶液进行滴定,达到终点时消耗标准液13.35 mL。(已知:AlCl3的相对分子质量为133.5)(6)该样品中AlCl3的质量分数为
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质
您最近一年使用:0次
2021·四川德阳·二模
3 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
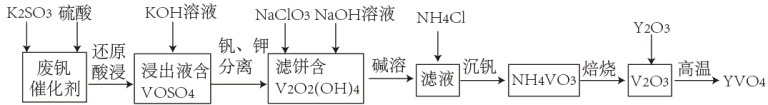
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是_______ 。V2O5被还原的离子方程式为_______ 。
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH_______ 7(填“>”“<”或“=”)。
(3)结合“碱溶”和“沉钒”可知, 、
、 中
中_______ 的氧化性更强,“沉钒”时发生反应的化学方程式为_______ 。
(4)利用上述表格数据,计算Fe(OH)2的Ksp=_______ 。
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为_______ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH
(3)结合“碱溶”和“沉钒”可知,
 、
、 中
中(4)利用上述表格数据,计算Fe(OH)2的Ksp=
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为
您最近一年使用:0次



