名校
1 . 氧化钴常用作超耐热合金和磁性材料及化学工业的催化剂。一种以 -萘酚钴渣(含有
-萘酚钴渣(含有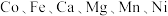 等元素的化合物及
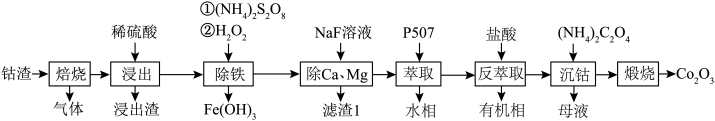
等元素的化合物及 )制备氧化钴的工艺流程如下。
)制备氧化钴的工艺流程如下。
已知:① -萘酚钴渣焙烧浸出后溶液中金属元素主要以
-萘酚钴渣焙烧浸出后溶液中金属元素主要以 价离子形式存在。
价离子形式存在。
②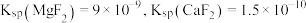 ;
;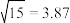 。
。
③溶液的氧化还原电势(E)为正,表示该溶液显示出一定的氧化性。氧化还原电势越高,氧化性越强;电势越低,氧化性越弱。
回答下列问题:
(1)“焙烧”过程中的主要气体产物为___________ (填化学式)。
(2)“除铁”过程中, 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
(3)“除铁”后滤液中 浓度分别为
浓度分别为 和
和 ,若取
,若取 该废液,则至少需加入
该废液,则至少需加入___________ 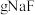 才能使该废液中
才能使该废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 可认为沉淀完全)。
可认为沉淀完全)。
(4)用萃取剂P507“萃取”后所得水相中主要含有的金属离子为___________ (填离子符号)。“煅烧”时主要反应的化学方程式为___________ 。
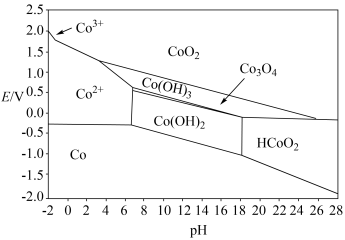
(5)钴元素的存在形式的稳定区域与溶液 的关系如图(
的关系如图(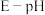 图)所示,在溶液
图)所示,在溶液 时,
时, 能将
能将 氧化,写出该反应的离子方程式:
氧化,写出该反应的离子方程式:___________ ;以1吨 -萘酚钴渣(
-萘酚钴渣( 的质量分数为
的质量分数为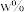 )为原料提取出
)为原料提取出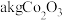 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为___________  (填含
(填含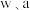 的表达式)。
的表达式)。
 -萘酚钴渣(含有
-萘酚钴渣(含有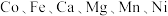 等元素的化合物及
等元素的化合物及 )制备氧化钴的工艺流程如下。
)制备氧化钴的工艺流程如下。
已知:①
 -萘酚钴渣焙烧浸出后溶液中金属元素主要以
-萘酚钴渣焙烧浸出后溶液中金属元素主要以 价离子形式存在。
价离子形式存在。②
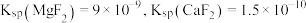 ;
;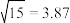 。
。③溶液的氧化还原电势(E)为正,表示该溶液显示出一定的氧化性。氧化还原电势越高,氧化性越强;电势越低,氧化性越弱。
回答下列问题:
(1)“焙烧”过程中的主要气体产物为
(2)“除铁”过程中,
 参与反应的离子方程式为
参与反应的离子方程式为(3)“除铁”后滤液中
 浓度分别为
浓度分别为 和
和 ,若取
,若取 该废液,则至少需加入
该废液,则至少需加入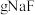 才能使该废液中
才能使该废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 可认为沉淀完全)。
可认为沉淀完全)。(4)用萃取剂P507“萃取”后所得水相中主要含有的金属离子为
(5)钴元素的存在形式的稳定区域与溶液
 的关系如图(
的关系如图(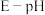 图)所示,在溶液
图)所示,在溶液 时,
时, 能将
能将 氧化,写出该反应的离子方程式:
氧化,写出该反应的离子方程式: -萘酚钴渣(
-萘酚钴渣( 的质量分数为
的质量分数为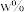 )为原料提取出
)为原料提取出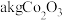 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为 (填含
(填含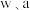 的表达式)。
的表达式)。
您最近一年使用:0次
2023-10-04更新
|
186次组卷
|
3卷引用:江西省百师联盟2023-2024学年高三开学考试化学试题
名校
2 . 一水硫酸四氨合铜 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
Ⅰ.制备少量晶体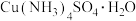 ,设计实验方案如下:
,设计实验方案如下:

(1)仪器A的名称为_____ ,对比铜和浓硫酸加热制备硫酸铜,该方案的优点是_____ 。
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是_____ 。
Ⅱ.氨含量的测定。精确称取 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%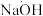 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
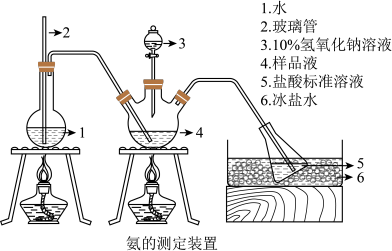
(3)“玻璃管2”的作用_____ ,样品中氨的质量分数的表达式_____ 。
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
(4)上述实验现象与配位离子的解离平衡有关,请用适当的化学用语表示该配位离子的解离平衡_____ ,则加入氢氧化钠溶液后的现象为_____ 。
 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题Ⅰ.制备少量晶体
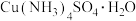 ,设计实验方案如下:
,设计实验方案如下:
(1)仪器A的名称为
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是
Ⅱ.氨含量的测定。精确称取
 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10% 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
(3)“玻璃管2”的作用
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1
 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:| 加入试剂 | 水 | 稀硫酸 | 氢氧化钠 |
| 现象 | 几乎无变化 | 溶液颜色变成浅蓝色,与同浓度硫酸铜颜色相当 |
您最近一年使用:0次
2023-08-16更新
|
265次组卷
|
3卷引用:江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题
江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升
解题方法
3 . 黄铁矿烧渣(主要成分为 、
、 、
、 、
、 等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备铁红
等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备铁红 的流程如图所示:
的流程如图所示:

回答下列问题:
(1)铁红是炼铁的重要原料,请再说出铁红的一种用途___________ 。
(2)为了提高酸浸的速率可采取的措施是___________ (写出一种即可),“操作1”后的溶液中溶质的主要成分是___________ (填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为________ ,操作2的名称是_________ 。
(4) 固体会吸附硫酸根离子等杂质,为检验
固体会吸附硫酸根离子等杂质,为检验 是否洗涤干净,取最后一次洗涤液于试管,
是否洗涤干净,取最后一次洗涤液于试管,___________ ,根据现象判断是否洗涤干净。
(5)现有黄铁矿烧渣 ,铁元素的质量分数为11.2%,经过一系列转化后,得到
,铁元素的质量分数为11.2%,经过一系列转化后,得到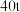 铁红,该产品的产率为
铁红,该产品的产率为___________ 。(提示:产率 )
)
 、
、 、
、 、
、 等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备铁红
等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备铁红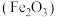 的流程如图所示:
的流程如图所示:
回答下列问题:
(1)铁红是炼铁的重要原料,请再说出铁红的一种用途
(2)为了提高酸浸的速率可采取的措施是
(3)“沉淀反应”时不宜混入过多空气,其原因为
(4)
 固体会吸附硫酸根离子等杂质,为检验
固体会吸附硫酸根离子等杂质,为检验 是否洗涤干净,取最后一次洗涤液于试管,
是否洗涤干净,取最后一次洗涤液于试管,(5)现有黄铁矿烧渣
 ,铁元素的质量分数为11.2%,经过一系列转化后,得到
,铁元素的质量分数为11.2%,经过一系列转化后,得到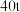 铁红,该产品的产率为
铁红,该产品的产率为 )
)
您最近一年使用:0次
名校
4 . 自古至今,铁及其化合物在人类生产生活中的使用发挥了巨大的作用。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是___________ (填化学式) 。
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式___________ 。
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):
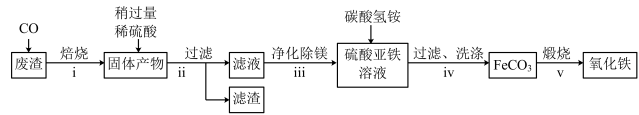
提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是___________ (填化学式)。
②步骤Ⅴ中,发生反应的化学方程式为___________ 。
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为___________ 。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):

提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是
②步骤Ⅴ中,发生反应的化学方程式为
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为
您最近一年使用:0次
2023-07-10更新
|
291次组卷
|
2卷引用:江西省宁冈中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
5 .  (一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成
(一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 ,遇有机物易燃烧或爆炸,
,遇有机物易燃烧或爆炸, 以上易分解。某化学研究小组设计如图装置以制备
以上易分解。某化学研究小组设计如图装置以制备 (支撑及夹持等转置已省略)。
(支撑及夹持等转置已省略)。
已知:①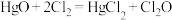 (反应放热);②D装置中的特型烧瓶内装有附着
(反应放热);②D装置中的特型烧瓶内装有附着 粉末的玻璃丝。
粉末的玻璃丝。

请回答:
(1)装置B中盛有的最佳试剂是___________ ;
(2)写出装置A中制备 的离子方程式
的离子方程式___________ ;反应中每生成 ,则被氧化的
,则被氧化的 为
为___________  。
。
(3)装置A中使用该恒压漏斗的目的是___________ ;
(4)装置D中采用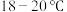 水浴的原因之一:温度过低,反应速率慢;另一个原因
水浴的原因之一:温度过低,反应速率慢;另一个原因___________ ;
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(氧化能力相同,即有效氯生成氯离子时,转移电子数目相同)。
的氧化能力(氧化能力相同,即有效氯生成氯离子时,转移电子数目相同)。 的有效氯含量为
的有效氯含量为___________ (计算结果保留两位小数)。
(6) 的另一种制备方法是利用
的另一种制备方法是利用 与适量潮湿的
与适量潮湿的 反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式___________ 。
 (一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成
(一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 ,遇有机物易燃烧或爆炸,
,遇有机物易燃烧或爆炸, 以上易分解。某化学研究小组设计如图装置以制备
以上易分解。某化学研究小组设计如图装置以制备 (支撑及夹持等转置已省略)。
(支撑及夹持等转置已省略)。已知:①
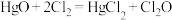 (反应放热);②D装置中的特型烧瓶内装有附着
(反应放热);②D装置中的特型烧瓶内装有附着 粉末的玻璃丝。
粉末的玻璃丝。
请回答:
(1)装置B中盛有的最佳试剂是
(2)写出装置A中制备
 的离子方程式
的离子方程式 ,则被氧化的
,则被氧化的 为
为 。
。(3)装置A中使用该恒压漏斗的目的是
(4)装置D中采用
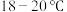 水浴的原因之一:温度过低,反应速率慢;另一个原因
水浴的原因之一:温度过低,反应速率慢;另一个原因(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(氧化能力相同,即有效氯生成氯离子时,转移电子数目相同)。
的氧化能力(氧化能力相同,即有效氯生成氯离子时,转移电子数目相同)。 的有效氯含量为
的有效氯含量为(6)
 的另一种制备方法是利用
的另一种制备方法是利用 与适量潮湿的
与适量潮湿的 反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO等,工艺流程简化示意图如下:

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是使_____________________________ 。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数∶氧原子数∶氢原子数=________ 。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式________________________ 。该反应的基本类型是_____________ 。
(4)“滤液3”之前加入锌粉的目的是__________________ 。
(5)“滤液3”之后的操作依次为________ 、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于___________ ×100%。

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是使
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数∶氧原子数∶氢原子数=
(3)请写出氢氧化锌和稀硫酸反应的化学方程式
(4)“滤液3”之前加入锌粉的目的是
(5)“滤液3”之后的操作依次为
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
您最近一年使用:0次



