1 . 连二亚硫酸钠( )是无机精细化学品,在造纸、印染等行业应用广泛。可通过以下方案制备
)是无机精细化学品,在造纸、印染等行业应用广泛。可通过以下方案制备 并测定其纯度。
并测定其纯度。
Ⅰ. 的制备
的制备
步骤1:安装好整套装置,并检查气密性;
步骤2:在三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液;
步骤3:打开仪器a的活塞,向装置C中通入一段时间 ;
;
步骤4:打开仪器c的活塞,滴加稍过量NaOH溶液,控制pH在8.2~10.5之间;
步骤5:过滤,将滤液经“一系列操作”可获得 。
。
已知:① 在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定。
在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定。
②低于52℃时 在水溶液中以
在水溶液中以 形态结晶,高于52℃时
形态结晶,高于52℃时 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。
③ 呈现两性。请回答:
呈现两性。请回答:

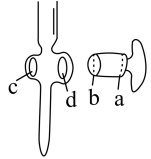
(1)仪器b的名称是_______ 。
(2)装置B的作用是防倒吸,将下图补充完整代替装置B_______ 。

(3)步骤3中生成物为 ,该反应需在
,该反应需在 进行,其原因为
进行,其原因为_______ 。
(4)下列步骤4说法不正确 的是_______。
(5)“一系列操作”包括:a. 趁热过滤;b. 用乙醇洗涤;c. 搅拌下用水蒸气加热至60℃左右;d. 分批加入细食盐粉,搅拌使其结晶,用倾析法除去上层溶液,余少量母液。
上述操作的合理顺序为_______ →干燥(填字母)。
Ⅱ. 含量的测定
实验原理: (未配平)。
(未配平)。
实验过程需在氮气氛围中进行,称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加 标准溶液,达到滴定终点时消耗25.00mL标准溶液。
标准溶液,达到滴定终点时消耗25.00mL标准溶液。
(6)样品中 的质量分数为
的质量分数为_______ (假设杂质不参与反应);若实验过程中未通入 ,对测定
,对测定 含量的影响是
含量的影响是_______ (填“偏低”、“偏高”或“无影响”)。
 )是无机精细化学品,在造纸、印染等行业应用广泛。可通过以下方案制备
)是无机精细化学品,在造纸、印染等行业应用广泛。可通过以下方案制备 并测定其纯度。
并测定其纯度。Ⅰ.
 的制备
的制备步骤1:安装好整套装置,并检查气密性;
步骤2:在三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液;
步骤3:打开仪器a的活塞,向装置C中通入一段时间
 ;
;步骤4:打开仪器c的活塞,滴加稍过量NaOH溶液,控制pH在8.2~10.5之间;
步骤5:过滤,将滤液经“一系列操作”可获得
 。
。已知:①
 在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定。
在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定。②低于52℃时
 在水溶液中以
在水溶液中以 形态结晶,高于52℃时
形态结晶,高于52℃时 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。③
 呈现两性。请回答:
呈现两性。请回答:
(1)仪器b的名称是
(2)装置B的作用是防倒吸,将下图补充完整代替装置B

(3)步骤3中生成物为
 ,该反应需在
,该反应需在 进行,其原因为
进行,其原因为(4)下列步骤4说法
A.pH过大 沉淀完全,且 沉淀完全,且 能稳定存在 能稳定存在 |
B.pH过小 会沉淀不完全,产品中会产生含锌杂质 会沉淀不完全,产品中会产生含锌杂质 |
| C.装置C中溶液均应用无氧水配制 |
| D.不可以用碳酸钠溶液代替氢氧化钠溶液 |
上述操作的合理顺序为
Ⅱ. 含量的测定
实验原理:
 (未配平)。
(未配平)。实验过程需在氮气氛围中进行,称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加
 标准溶液,达到滴定终点时消耗25.00mL标准溶液。
标准溶液,达到滴定终点时消耗25.00mL标准溶液。(6)样品中
 的质量分数为
的质量分数为 ,对测定
,对测定 含量的影响是
含量的影响是
您最近一年使用:0次
2 . 氯化亚铜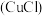 是一种重要的化工产品,它难溶于水和乙醇,可溶于浓
是一种重要的化工产品,它难溶于水和乙醇,可溶于浓 与氨水形成的混合物,置于潮湿空气中迅速氧化为
与氨水形成的混合物,置于潮湿空气中迅速氧化为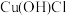 而变为绿色。实验室用酸性蚀刻液(含
而变为绿色。实验室用酸性蚀刻液(含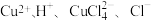 )和碱性蚀刻液[含
)和碱性蚀刻液[含 ]来制备
]来制备 ,实验过程的流程如下:
,实验过程的流程如下:
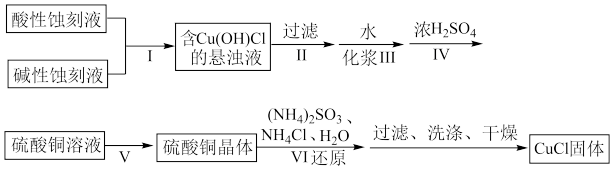
(1)步骤Ⅳ需要控制 为1~2、
为1~2、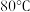 下进行,合适的加热方式是
下进行,合适的加热方式是_______ 。
(2)步骤Ⅴ为了得到较为纯净的硫酸铜晶体,根据下表中物质的溶解度(单位为g)随温度的变化,写出步骤Ⅴ得到硫酸铜晶体的操作:_______ 。
(3)写出还原过程中发生主要反应的离子方程式:_______ 。
(4)步骤Ⅵ在图装置中进行,启动磁力撒搅拌器,使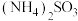 和
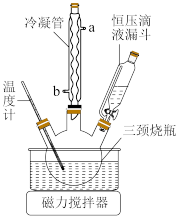
和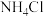 混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
(5) 的定量分析,称取样品
的定量分析,称取样品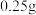 置于预先放入玻璃珠和过量
置于预先放入玻璃珠和过量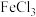 溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入
溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入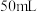 水、邻菲罗啉指示剂2滴,立即用
水、邻菲罗啉指示剂2滴,立即用 的硫酸铈标准液滴定至绿色出现为终点,消耗标准液
的硫酸铈标准液滴定至绿色出现为终点,消耗标准液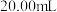 ,发生的反应为
,发生的反应为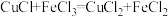 ,
, ,则
,则
①加入玻璃珠的作用是_______ 。
②下列有关上述滴定操作的说法正确的是_______ 。
A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准液体积小于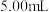 ,则第二次滴定时可稀释待测液后重新滴定来减小误差
,则第二次滴定时可稀释待测液后重新滴定来减小误差
③样品的 的质量分数为
的质量分数为_______ 。
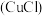 是一种重要的化工产品,它难溶于水和乙醇,可溶于浓
是一种重要的化工产品,它难溶于水和乙醇,可溶于浓 与氨水形成的混合物,置于潮湿空气中迅速氧化为
与氨水形成的混合物,置于潮湿空气中迅速氧化为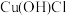 而变为绿色。实验室用酸性蚀刻液(含
而变为绿色。实验室用酸性蚀刻液(含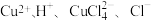 )和碱性蚀刻液[含
)和碱性蚀刻液[含 ]来制备
]来制备 ,实验过程的流程如下:
,实验过程的流程如下:
(1)步骤Ⅳ需要控制
 为1~2、
为1~2、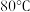 下进行,合适的加热方式是
下进行,合适的加热方式是(2)步骤Ⅴ为了得到较为纯净的硫酸铜晶体,根据下表中物质的溶解度(单位为g)随温度的变化,写出步骤Ⅴ得到硫酸铜晶体的操作:
| 温度 物质 |  | 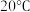 | 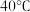 | 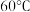 | 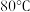 | 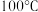 |
| 氯化铜 | 75 | 80 | 85 | 90 | 100 | 108 |
| 硫酸铜 | 12 | 18 | 30 | 50 | 60 | 87 |
(4)步骤Ⅵ在图装置中进行,启动磁力撒搅拌器,使
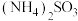 和
和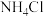 混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
| A.装置中的温度计显示温度会迅速升高 |
B.滴加太快容易发生其他副反应,而使制得的 产品纯度下降 产品纯度下降 |
C.冷凝管上口排出的气体主要是 |
| D.该兴趣小组制备过程中产生滤液、洗涤液等要进行无害化处理后才能排放 |
 的定量分析,称取样品
的定量分析,称取样品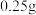 置于预先放入玻璃珠和过量
置于预先放入玻璃珠和过量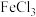 溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入
溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入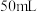 水、邻菲罗啉指示剂2滴,立即用
水、邻菲罗啉指示剂2滴,立即用 的硫酸铈标准液滴定至绿色出现为终点,消耗标准液
的硫酸铈标准液滴定至绿色出现为终点,消耗标准液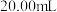 ,发生的反应为
,发生的反应为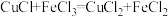 ,
, ,则
,则①加入玻璃珠的作用是
②下列有关上述滴定操作的说法正确的是

A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准液体积小于
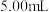 ,则第二次滴定时可稀释待测液后重新滴定来减小误差
,则第二次滴定时可稀释待测液后重新滴定来减小误差③样品的
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
3 . 啤酒常用焦亚硫酸钠(Na2S2O5)作抗氧化剂。某工厂按如图工艺生产焦亚硫酸钠,兴趣小组在啤酒厂水质检验员指导下,测定啤酒中抗氧化剂的含量。

已知:①亚硫酸氢钠达到过饱和溶液,能析出Na2S2O5晶体,2NaHSO3 Na2S2O5+H2O;
Na2S2O5+H2O;
②测定抗氧化剂的残留量是以游离的SO2含量计算的。
回答下列问题:
(1)燃烧炉中主要反应的化学方程式为_________ 。
(2)在纯碱溶液中通入SO2调至pH为4.1时,产物中含NaHSO3,反应液温度升高,其化学方程式为_________ ;在NaHSO3溶液中加入纯碱溶液调至pH为7~8时,NaHSO3转化为Na2SO3悬浮液,Na2SO3悬浮液中继续通入SO2调至pH为4.1时,生成亚硫酸氢钠过饱和溶液,写出该反应的化学方程式:_________ 。
(3)下列说法不正确 的是_________ 。
(4)为了减少产品Na2S2O5中杂质含量,需控制SO2气体与纯碱固体的物质的量之比为2∶1。
否则产品中会混有碳酸钠杂质,检验杂质选择试剂最简单 的组合是_______ (填编号)。
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④NaOH ⑤稀硝酸 ⑥稀硫酸
(5)兴趣小组向330.00mL啤酒中加入适量的稀硫酸,加热使气体全部逸出通入足量的H2O2中,只有SO2与H2O2反应,微热后,将反应液体转移至小烧杯中,向烧杯内逐滴加入BaCl2溶液至沉淀量不再增加,过滤、洗涤、干燥,称得固体质量为0.0072g,则该啤酒中抗氧化剂的残留量为________ mg/L(以SO2计)。

已知:①亚硫酸氢钠达到过饱和溶液,能析出Na2S2O5晶体,2NaHSO3
 Na2S2O5+H2O;
Na2S2O5+H2O;②测定抗氧化剂的残留量是以游离的SO2含量计算的。
回答下列问题:
(1)燃烧炉中主要反应的化学方程式为
(2)在纯碱溶液中通入SO2调至pH为4.1时,产物中含NaHSO3,反应液温度升高,其化学方程式为
(3)下列说法
| A.I、II、III设备分别为除杂装置、冷却装置和过滤装置 |
| B.反应器中反应需在恒温下进行,三反应器中若溶液温度突然下降,说明反应已完成 |
| C.生产工艺中为了使硫黄充分燃烧,需通入过量压缩空气 |
| D.Na2S2O5不稳定,易溶于水且与水反应后溶液呈酸性 |
否则产品中会混有碳酸钠杂质,检验杂质选择试剂
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④NaOH ⑤稀硝酸 ⑥稀硫酸
(5)兴趣小组向330.00mL啤酒中加入适量的稀硫酸,加热使气体全部逸出通入足量的H2O2中,只有SO2与H2O2反应,微热后,将反应液体转移至小烧杯中,向烧杯内逐滴加入BaCl2溶液至沉淀量不再增加,过滤、洗涤、干燥,称得固体质量为0.0072g,则该啤酒中抗氧化剂的残留量为
您最近一年使用:0次
4 .  是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点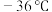 ,沸点
,沸点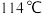 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
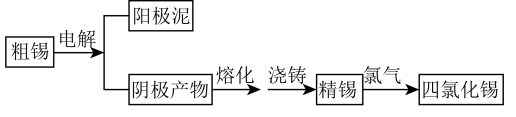
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸 和硅氟酸亚锡
和硅氟酸亚锡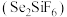 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为___________ 。阴极的电极反应式为___________ ,根据价层电子对互斥理论和杂化轨道理论,判断 离子的空间构型是
离子的空间构型是___________ ,硅的杂化类型是___________ 。
(2)某同学模拟工业制法设计了由 与
与 反应制取
反应制取 的实验装置:
的实验装置:
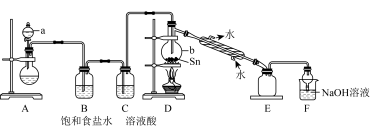
①a中浓盐酸与烧瓶内固体反应生成 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用___________ ,仪器b的名称为___________ 。
②装置D的主要缺点是___________ ,除此之外,整套装置还有的缺点是___________ 。
③制取 中可能会产生少量
中可能会产生少量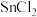 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液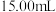 ,则产品中
,则产品中 的含量为
的含量为___________  (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是___________ (用离子方程式表示)。
 是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点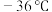 ,沸点
,沸点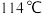 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸
 和硅氟酸亚锡
和硅氟酸亚锡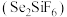 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为 离子的空间构型是
离子的空间构型是(2)某同学模拟工业制法设计了由
 与
与 反应制取
反应制取 的实验装置:
的实验装置:
①a中浓盐酸与烧瓶内固体反应生成
 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用②装置D的主要缺点是
③制取
 中可能会产生少量
中可能会产生少量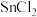 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液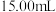 ,则产品中
,则产品中 的含量为
的含量为 (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
您最近一年使用:0次
名校
解题方法
5 . Pd/Al2O3是常见的汽车尾气催化剂。一种废Pd/Al2O3纳米催化剂主要成分及含量:Pd 0.3%,Al2O3 92.8%,SiO2 5.0%,Co、Pt和炭共约1.0%。采用如下工艺从中提取金属Co和Pd。

请回答下列问题:
(1)方法2比方法1后续回收流程相对简单,但工业上不常用方法2,从绿色化学角度分析原因是_______ 。
(2)“酸浸②”时,Pt和Pd分别转化为PtCl 和PdCl
和PdCl ,请写出Pd转化为PdCl
,请写出Pd转化为PdCl 的离子方程式为
的离子方程式为_______ 。
(3)为了精准投料,需要测定“络合”过程加入的氨水溶液的浓度。待测液用碱式滴定管量取,选出正确操作完成“量取”操作:蒸馏水洗涤→加入待装液3~5mL→_______→_______→_______→_______→ d。_______

a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm,放一定体积液,读数
e.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
f.橡皮管向上弯曲,挤压玻璃球a处,放液
g.橡皮管向上弯曲,挤压玻璃球b处,放液
h.橡皮管向上弯曲,挤压玻璃球c处,放液
(4)“络合”过程后得到Pd(NH3)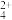 和Pt(NH3)
和Pt(NH3)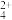 ,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因
,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因_______ 。
(5)已知:常温下,Ksp[Co(OH)2]=10−15,Ksp[Al(OH)3]=10−32。若滤液①中c(Co2+) = 0.01 mol·L−1,则分离出Al(OH)3沉淀需调节pH的范围是_______ (当离子浓度小于1.0×10−5 mol·L−1时认为已沉淀完全),调节pH可以选择的最佳物质是_______ (填序号)
A.Al2O3 B.NaOH C.CoO D.NaHCO3

请回答下列问题:
(1)方法2比方法1后续回收流程相对简单,但工业上不常用方法2,从绿色化学角度分析原因是
(2)“酸浸②”时,Pt和Pd分别转化为PtCl
 和PdCl
和PdCl ,请写出Pd转化为PdCl
,请写出Pd转化为PdCl 的离子方程式为
的离子方程式为(3)为了精准投料,需要测定“络合”过程加入的氨水溶液的浓度。待测液用碱式滴定管量取,选出正确操作完成“量取”操作:蒸馏水洗涤→加入待装液3~5mL→_______→_______→_______→_______→ d。

a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm,放一定体积液,读数
e.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
f.橡皮管向上弯曲,挤压玻璃球a处,放液
g.橡皮管向上弯曲,挤压玻璃球b处,放液
h.橡皮管向上弯曲,挤压玻璃球c处,放液
(4)“络合”过程后得到Pd(NH3)
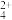 和Pt(NH3)
和Pt(NH3)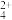 ,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因
,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因(5)已知:常温下,Ksp[Co(OH)2]=10−15,Ksp[Al(OH)3]=10−32。若滤液①中c(Co2+) = 0.01 mol·L−1,则分离出Al(OH)3沉淀需调节pH的范围是
A.Al2O3 B.NaOH C.CoO D.NaHCO3
您最近一年使用:0次
解题方法
6 . 某实验小组拟用碱性烂版液{主要成分为[Cu(NH3)4]Cl2和Cu(OH)2}为原料制取摩尔盐,并回收铜单质,设计流程如图:

已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式_______ 。
(2)实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是_______ 。
(3)关于该实验过程的下列说法中正确的是_______ 。

A.所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
B.溶液A.与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解l mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
(4)为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:_______ 。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净:_______ 。
(6)为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为_______ 。


已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式
(2)实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是
(3)关于该实验过程的下列说法中正确的是

A.所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
B.溶液A.与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解l mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
(4)为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净:
(6)为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为

您最近一年使用:0次
解题方法
7 . 某小组进行测定某变质的铁铝合金(杂质主要为Al2O3和Fe2O3)样品中铁含量,并制备Fe3O4胶体粒子,相关实验方案设计如下:
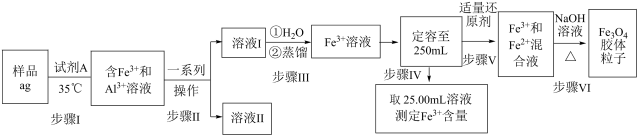
已知:乙醚[(C2H5)2O]易燃,沸点为34.5度,微溶于水,密度比水小。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答下列问题:
(1)溶液II中主要金属阳离子是__________________ 。
(2)步骤I中试剂A最佳选择 的是_____________ 。
A.浓硝酸 B.浓硫酸 C.浓盐酸+双氧水 D.稀盐酸+双氧水
(3)步骤II的“一系列操作”包括如下实验步骤,选出其正确操作并按序列出字母:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏斗→( ) →( ) →( ) →( ) →f→( ) →a→( ) →d→( ) 。
a.左手拇指和食指旋开旋塞放气;
b.用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇;
c.静置分层;
d.打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出;
e.混合两次分液后的上层液体;
f.向下层液体中加入浓盐酸和乙醚并转移至分液漏斗;
(4)下列关于步骤Ⅲ和步骤VI的涉及的操作说法正确的是_______________ 。
A.步骤Ⅲ中蒸馏操作时,为加快蒸馏速度,采用酒精灯大火加热,收集34.5℃的馏分
B.为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中
C.步骤VI由混合溶液制得Fe3O4胶体粒子的过程中,须持续通入N2,防止Fe2+被氧化
D.析出Fe3O4胶体粒子后通过抽滤,洗涤,干燥获得Fe3O4胶体粒子
(5)步骤IV测定Fe3+方法有多种,如转化为Fe2O3,间接碘量滴定,分光光度法等。
①步骤IV主要作用是测定样品中的铁总含量和______________________ 。
②步骤IV实验时采用间接碘量法测定Fe3+含量,具体过程如下:向25.00mL溶液中加入过量KI溶液,充分反应后,滴入几滴淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液体积为VmL。已知滴定反应为:I2+2Na2S2O3=2NaI+Na2S4O6。不考虑Fe3+和I-反应限度和滴定操作问题,实际测定的Fe含量往往偏高,其主要原因是________________________________________ 。

已知:乙醚[(C2H5)2O]易燃,沸点为34.5度,微溶于水,密度比水小。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答下列问题:
(1)溶液II中主要金属阳离子是
(2)步骤I中试剂A
A.浓硝酸 B.浓硫酸 C.浓盐酸+双氧水 D.稀盐酸+双氧水
(3)步骤II的“一系列操作”包括如下实验步骤,选出其正确操作并按序列出字母:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏斗→
a.左手拇指和食指旋开旋塞放气;
b.用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇;
c.静置分层;
d.打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出;
e.混合两次分液后的上层液体;
f.向下层液体中加入浓盐酸和乙醚并转移至分液漏斗;
(4)下列关于步骤Ⅲ和步骤VI的涉及的操作说法正确的是
A.步骤Ⅲ中蒸馏操作时,为加快蒸馏速度,采用酒精灯大火加热,收集34.5℃的馏分
B.为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中
C.步骤VI由混合溶液制得Fe3O4胶体粒子的过程中,须持续通入N2,防止Fe2+被氧化
D.析出Fe3O4胶体粒子后通过抽滤,洗涤,干燥获得Fe3O4胶体粒子
(5)步骤IV测定Fe3+方法有多种,如转化为Fe2O3,间接碘量滴定,分光光度法等。
①步骤IV主要作用是测定样品中的铁总含量和
②步骤IV实验时采用间接碘量法测定Fe3+含量,具体过程如下:向25.00mL溶液中加入过量KI溶液,充分反应后,滴入几滴淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液体积为VmL。已知滴定反应为:I2+2Na2S2O3=2NaI+Na2S4O6。不考虑Fe3+和I-反应限度和滴定操作问题,实际测定的Fe含量往往偏高,其主要原因是
您最近一年使用:0次
2020-05-05更新
|
319次组卷
|
2卷引用:浙江省“山水联盟”2020届高三下学期返校考化学试题



