名校
解题方法
1 . 三氯化六氨合钴(III) [Co(NH3)6]Cl3 在工业上用途广泛。
已知:[Co(NH3)6]Cl3溶于热水,微溶于冷水。实验室制备 [Co(NH3)6]Cl3 的步骤如下:
I.检查装置气密性并将CoCl2 、 NH4Cl 和活性炭在三颈烧瓶中混合,滴加浓氨水,充分反应后缓慢滴加双氧水,控制温度为 50~60℃,加热 20 min,实验装置下图所示。
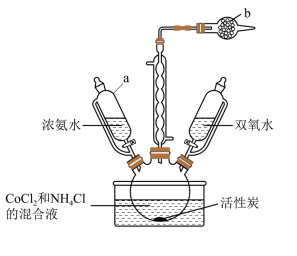
Ⅱ.将所得浊液趁热过滤,向滤液中逐滴加入少量浓盐酸。
Ⅲ.冷却结晶后过滤,用少量冷水和无水乙醇分别洗涤晶体 2~3 次。
(1)图中仪器的 a 名称为_____ ;b 中装的固体是_____ 。
(2)步骤 I 中控制温度为 50~60℃的方法为____ ,温度不宜过高的原因是_____ 。
(3)向滤液中加入浓盐酸的作用是_________ 。
(4)步骤 III 中用乙醇洗涤的优点是_________ 。
(5)用如图装置测定产品中NH3 的含量(部分装置已省略):
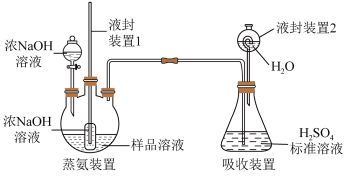
①蒸氨:取 xg 样品加入过量试剂后,加热三颈烧瓶,蒸出的 NH3 通入盛有V1mL c1mol/LH2SO4标准溶液的锥形瓶中。
②滴定:将液封装置 2 中的水倒入锥形瓶后,用c2mol/L NaOH 标准溶液滴定剩余的H2SO4,消耗V2mL NaOH 标准溶液。滴定时选用的指示剂为_____ ,计算得NH3 的质量分数为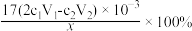 ;若 NaOH 标准溶液使用前敞口放置于空气中一段时间,测得NH3 的含量
;若 NaOH 标准溶液使用前敞口放置于空气中一段时间,测得NH3 的含量_____ (填“偏高”、“偏低”或“无影响”)。
已知:[Co(NH3)6]Cl3溶于热水,微溶于冷水。实验室制备 [Co(NH3)6]Cl3 的步骤如下:
I.检查装置气密性并将CoCl2 、 NH4Cl 和活性炭在三颈烧瓶中混合,滴加浓氨水,充分反应后缓慢滴加双氧水,控制温度为 50~60℃,加热 20 min,实验装置下图所示。

Ⅱ.将所得浊液趁热过滤,向滤液中逐滴加入少量浓盐酸。
Ⅲ.冷却结晶后过滤,用少量冷水和无水乙醇分别洗涤晶体 2~3 次。
(1)图中仪器的 a 名称为
(2)步骤 I 中控制温度为 50~60℃的方法为
(3)向滤液中加入浓盐酸的作用是
(4)步骤 III 中用乙醇洗涤的优点是
(5)用如图装置测定产品中NH3 的含量(部分装置已省略):

①蒸氨:取 xg 样品加入过量试剂后,加热三颈烧瓶,蒸出的 NH3 通入盛有V1mL c1mol/LH2SO4标准溶液的锥形瓶中。
②滴定:将液封装置 2 中的水倒入锥形瓶后,用c2mol/L NaOH 标准溶液滴定剩余的H2SO4,消耗V2mL NaOH 标准溶液。滴定时选用的指示剂为
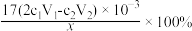 ;若 NaOH 标准溶液使用前敞口放置于空气中一段时间,测得NH3 的含量
;若 NaOH 标准溶液使用前敞口放置于空气中一段时间,测得NH3 的含量
您最近一年使用:0次
2 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
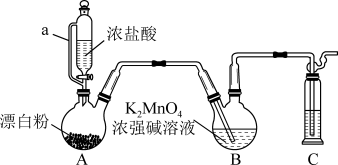
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
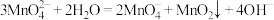
回答下列问题:
(1)装置A中a的作用是______________ ;装置C中的试剂为________________ ;装置A中制备Cl2的化学方程为______________ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________ 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________ (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________ (填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含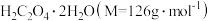 的质量分数表达式为
的质量分数表达式为_________________ 。
下列关于样品组成分析的说法,正确的是__________ (填标号)。
A.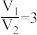 时,样品中一定不含杂质
时,样品中一定不含杂质
B.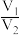 越大,样品中
越大,样品中 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
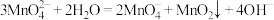
回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含
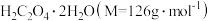 的质量分数表达式为
的质量分数表达式为下列关于样品组成分析的说法,正确的是
A.
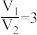 时,样品中一定不含杂质
时,样品中一定不含杂质B.
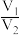 越大,样品中
越大,样品中 含量一定越高
含量一定越高C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
您最近一年使用:0次
2020-07-11更新
|
9285次组卷
|
27卷引用:福建省福州市第一中学2021届高三上学期开学质检化学试题
福建省福州市第一中学2021届高三上学期开学质检化学试题河南省三门峡市第一高级中学2021届高三8月开学考试化学试题山东省济宁市实验中学2022届高三上学期开学考试化学试题山东省临沂市临沭第一中学2022届高三上学期开学考试化学试题北京市第二十中学2022-2023学年高三下学期开学检测化学试题2020年山东省高考化学试卷(新高考)(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编江西省高安中学2020-2021学年高二上学期第一次段考化学(A)试题黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题选择性必修1 专题3素养检测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省潍坊市第一中学2022届高三10月月考化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 化学综合实验 热点5 物质制备实验与定量测定实验(已下线)专题19 实验综合题
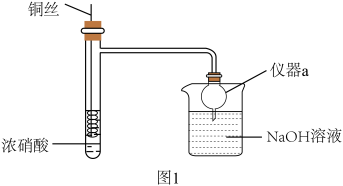
3 . Cu与浓 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
回答下列问题:
(1)Cu与浓 反应的离子方程式为
反应的离子方程式为_______ 。
(2)关于该实验下列说法错误的是_______ 。
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a: 浓度大
浓度大
猜想b: 溶解在
溶解在 溶液中
溶液中
猜想c:由于 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应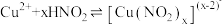 (绿色)
(绿色)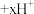
【实验探究】
实验i:配制饱和 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。
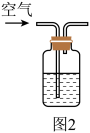
实验ii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色。
实验iii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
【实验结论】
对比实验ii与实验iii,可推测 溶液为绿色的原因主要是
溶液为绿色的原因主要是_______ 。
(4)小组同学还针对产物 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。
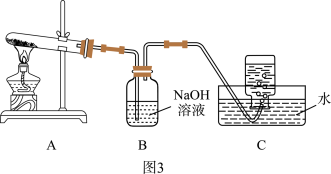
①从实验安全角度考虑,需要在A、B间加入_______ 装置。
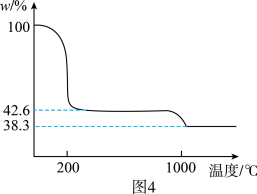
②图4为 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为_______ ,继续高温至1000℃生成_______ (填化学式)固体。
 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
回答下列问题:
(1)Cu与浓
 反应的离子方程式为
反应的离子方程式为(2)关于该实验下列说法错误的是
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓
 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。【提出猜想】
猜想a:
 浓度大
浓度大猜想b:
 溶解在
溶解在 溶液中
溶液中猜想c:由于
 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应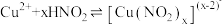 (绿色)
(绿色)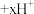
【实验探究】
实验i:配制饱和
 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。实验ii:取适量Cu与浓
 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到实验iii:取适量Cu与浓
 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
【实验结论】
对比实验ii与实验iii,可推测
 溶液为绿色的原因主要是
溶液为绿色的原因主要是(4)小组同学还针对产物
 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。
①从实验安全角度考虑,需要在A、B间加入
②图4为
 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为
您最近一年使用:0次
2023-06-06更新
|
584次组卷
|
4卷引用:福建省漳州市华安县第一中学2023-2024学年高三上学期开学考试化学试题
福建省漳州市华安县第一中学2023-2024学年高三上学期开学考试化学试题福建省泉州第一中学2023届高三毕业班适应性测试化学试题(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
4 . 碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:

回答下列问题:
步骤Ⅰ用 Cl2氧化 I2制取 HIO3
(1)装置 A 中发生反应的化学方程式_______ 。
(2)装置 B 中的 CCl4可以加快反应速率,原因_______ 。
(3)反应结束后,获取 HIO3溶液的操作中,所需玻璃仪器有烧杯、________ 和_______ 。
步骤Ⅱ用 KOH 中和 HIO3制取 KIO3
(4)该中和反应的离子方程式为_______ 。中和之前,应将上述 HIO3溶液煮沸至接近无色,否则中和时易生成_______ (填化学式)而降低 KIO3的产量。
(5)往中和后的溶液中加入适量_______ ,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2饱和溶液过量,则无蓝色出现,原因是_______ 。
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3溶液的体积为 24.00 mL。则产品中 KIO3的质量分数为_______ 。[M(KIO3)=214.0 g·mol-1]
制取碘酸(HIO3)的实验装置示意图和有关资料如下:

| HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
| KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3- =IO4-+ Cl- |
步骤Ⅰ用 Cl2氧化 I2制取 HIO3
(1)装置 A 中发生反应的化学方程式
(2)装置 B 中的 CCl4可以加快反应速率,原因
(3)反应结束后,获取 HIO3溶液的操作中,所需玻璃仪器有烧杯、
步骤Ⅱ用 KOH 中和 HIO3制取 KIO3
(4)该中和反应的离子方程式为
(5)往中和后的溶液中加入适量
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2饱和溶液过量,则无蓝色出现,原因是
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3溶液的体积为 24.00 mL。则产品中 KIO3的质量分数为
您最近一年使用:0次
2020-02-13更新
|
390次组卷
|
3卷引用:福建省福州第一中学2020届高三下学期开学质检理科综合化学试题
名校
解题方法
5 . 磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________ 。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________ ,加入石灰调节溶液pH的范围为____________________ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________ (填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________ mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________ 。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________ %左右。


已知:几种金属离子沉淀的pH如下表。
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在

您最近一年使用:0次
2018-12-17更新
|
808次组卷
|
2卷引用:【全国百强校】福建省三明市第一中学2019届高三下学期开学考试理科综合化学试题
名校
6 . 毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备 BaCl2·2H2O 的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是_______ 。实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用下列仪器中的_______ (填标号)。
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
流程中,滤渣Ⅱ中含_______ (填化学式)。加入 H2C2O4时应避免过量,原因是_______ 。 [已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_______ (填“上方”或“下方”)。BaCl2溶液的浓度为___________ mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将_______ (填“偏大”或“偏小”或“无影响”)。

(1)毒重石用盐酸浸取前需充分研磨,目的是
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
| Ca2+ | Mg2 + | Fe3+ | |
| 开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的 pH | 13.9 | 11.1 | 3.2 |
流程中,滤渣Ⅱ中含
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的
您最近一年使用:0次



