名校
1 . 绿色植物标本用醋酸铜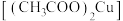 处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
I.醋酸铜晶体的制备
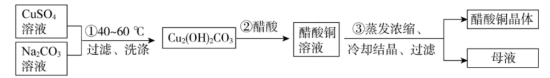
(1)①中控制温度为40-60度的原因是_______ 。
(2)②中化学方程式是_______ 。
(3)③中采用的实验方法依据醋酸铜的性质是_______ 。
Ⅱ.测定产品中铜的含量
i.取 醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量
醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量 溶液,产生
溶液,产生 沉淀,溶液呈棕黄色;
沉淀,溶液呈棕黄色;
ii.用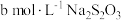 标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用
标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用 标准溶液滴定至蓝色近于消失:
标准溶液滴定至蓝色近于消失:
iii.向所得浊液中加入 溶液,充分摇动,溶液蓝色加深:
溶液,充分摇动,溶液蓝色加深:
iv.继续用 标准溶液滴定iii中浊液至终点,消耗标准溶液
标准溶液滴定iii中浊液至终点,消耗标准溶液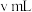 。
。
已知:① ,
, 溶液和
溶液和 溶液颜色均为无色;
溶液颜色均为无色;
②常温下,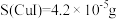
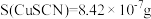
③ 易吸附
易吸附 ,
, 不吸附
不吸附 。被吸附的
。被吸附的 不与淀粉显色。
不与淀粉显色。
(4) i中发生反应的离子方程式是_______ 。
(5)结合平衡原理解释i中加入 的目的
的目的_______ 。
(6)醋酸铜产品中铜元素的质量分数是_______ 。
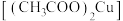 处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。I.醋酸铜晶体的制备

(1)①中控制温度为40-60度的原因是
(2)②中化学方程式是
(3)③中采用的实验方法依据醋酸铜的性质是
Ⅱ.测定产品中铜的含量
i.取
 醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量
醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量 溶液,产生
溶液,产生 沉淀,溶液呈棕黄色;
沉淀,溶液呈棕黄色;ii.用
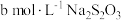 标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用
标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用 标准溶液滴定至蓝色近于消失:
标准溶液滴定至蓝色近于消失:iii.向所得浊液中加入
 溶液,充分摇动,溶液蓝色加深:
溶液,充分摇动,溶液蓝色加深:iv.继续用
 标准溶液滴定iii中浊液至终点,消耗标准溶液
标准溶液滴定iii中浊液至终点,消耗标准溶液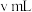 。
。已知:①
 ,
, 溶液和
溶液和 溶液颜色均为无色;
溶液颜色均为无色;②常温下,
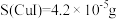
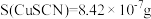
③
 易吸附
易吸附 ,
, 不吸附
不吸附 。被吸附的
。被吸附的 不与淀粉显色。
不与淀粉显色。(4) i中发生反应的离子方程式是
(5)结合平衡原理解释i中加入
 的目的
的目的(6)醋酸铜产品中铜元素的质量分数是
您最近一年使用:0次
名校
解题方法
2 . 钨精矿分解渣可回收制备氧化铁和碳酸锰。在70~80℃时,钨精矿分解渣用盐酸浸取,浸出液中主要金属离子为 、
、 、
、 ,还含有少量
,还含有少量 、
、 等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。 时,生成氢氧化物沉淀的
时,生成氢氧化物沉淀的 。
。
ⅱ、
(1)浸出液加入硫酸铵后,采取的分离操作是___________ 。
(2)沉淀1的主要成分是___________ 。
(3)已知,煅烧后的Fe2O3不溶于水和稀硝酸。粗氧化铁中除Fe2O3外,还含有的物质是___________ 。
(4)结合化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
(5)滤液3中含有 和
和 ,加入
,加入 主要沉淀出
主要沉淀出 的原因可能是
的原因可能是___________ 。
(6)碳酸锰含量测定。
步骤1:准确称取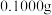 碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含
碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含 和
和 )加热至220℃~240℃,无小气泡冒出后,冷却至室温。
)加热至220℃~240℃,无小气泡冒出后,冷却至室温。
步骤2:用 硫酸亚铁铵
硫酸亚铁铵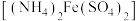 标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为
标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为 。
。
已知:ⅰ、 能与
能与 络合形成稳定的
络合形成稳定的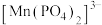 。
。
ⅱ、 的沸点为203℃。
的沸点为203℃。
①写出 将
将 氧化为
氧化为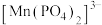 ,同时生成
,同时生成 的离子方程式
的离子方程式___________ 。
②碳酸锰样品中锰的质量分数为___________ 。
 、
、 、
、 ,还含有少量
,还含有少量 、
、 等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
 时,生成氢氧化物沉淀的
时,生成氢氧化物沉淀的 。
。| 氢氧化物 |  |  |  |  |
| 开始沉淀时 | 1.5 | 3.3 | 4.4 | 7.8 |
| 完全沉淀时 | 2.8 | 4.6 | 6.4 | 8.8 |
| 物质 |  |  |  |  |  |
 |  | 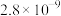 |  | 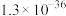 | 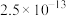 |
(2)沉淀1的主要成分是
(3)已知,煅烧后的Fe2O3不溶于水和稀硝酸。粗氧化铁中除Fe2O3外,还含有的物质是
(4)结合化学用语解释
 溶液呈碱性的原因
溶液呈碱性的原因(5)滤液3中含有
 和
和 ,加入
,加入 主要沉淀出
主要沉淀出 的原因可能是
的原因可能是(6)碳酸锰含量测定。
步骤1:准确称取
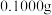 碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含
碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含 和
和 )加热至220℃~240℃,无小气泡冒出后,冷却至室温。
)加热至220℃~240℃,无小气泡冒出后,冷却至室温。步骤2:用
 硫酸亚铁铵
硫酸亚铁铵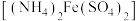 标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为
标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为 。
。已知:ⅰ、
 能与
能与 络合形成稳定的
络合形成稳定的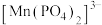 。
。ⅱ、
 的沸点为203℃。
的沸点为203℃。①写出
 将
将 氧化为
氧化为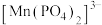 ,同时生成
,同时生成 的离子方程式
的离子方程式②碳酸锰样品中锰的质量分数为
您最近一年使用:0次
2023-04-29更新
|
439次组卷
|
3卷引用:北京市第四中学顺义分校2023-2024学年高三下学期3月开学考试化学试题
3 . 以废旧铅酸电池中的含铅废料( 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:
ii.
(1)溶浸
 均转化为
均转化为 。
。
①上述流程中能提高含铅废料中铅的浸出率的措施有_______ 。
② 转化为
转化为 的反应有:
的反应有: 、
、_______ 。
(2)结晶
①所得 中含有少量
中含有少量 ,原因是
,原因是_______ (用方程式表示)。
②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
循环3次后, 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入_____ (填试剂),过滤,滤液可再次参与循环。
(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。_______ 。
(4)测定废料中铅的含量
将 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数_______ 。
资料:滴定原理为:
 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:

ii.

(1)溶浸
 均转化为
均转化为 。
。①上述流程中能提高含铅废料中铅的浸出率的措施有
②
 转化为
转化为 的反应有:
的反应有: 、
、(2)结晶
①所得
 中含有少量
中含有少量 ,原因是
,原因是②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
 纯度/% 纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。
(4)测定废料中铅的含量
将
 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数资料:滴定原理为:

您最近一年使用:0次
2023-01-08更新
|
355次组卷
|
4卷引用:北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
4 . 白云石的主要化学成分为 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
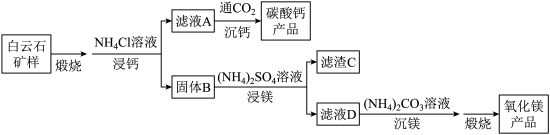
已知:
(1)白云石矿样煅烧完全分解的化学方程式为___________ 。
(2)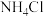 用量对碳酸钙产品的影响如下表
用量对碳酸钙产品的影响如下表
备注:ⅰ、 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量) (M代表Ca或Mg)
(M代表Ca或Mg)
ⅱ、 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。
①解释“浸钙”过程中主要浸出 的原因是
的原因是___________ 。
②沉钙反应的离子方程式为___________ 。
③“浸钙”过程不适宜选用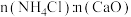 的比例为
的比例为___________ 。
④产品中 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是___________ 。
(3)“浸镁”过程中,取固体B与一定浓度的 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是___________ 。
(4)滤渣C中含有的物质是___________ 。
(5)该流程中可循环利用的物质是___________ 。
 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 |  |  |  |  |
 | 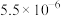 |  |  | 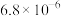 |
(1)白云石矿样煅烧完全分解的化学方程式为
(2)
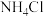 用量对碳酸钙产品的影响如下表
用量对碳酸钙产品的影响如下表| n(NH4Cl)/n(CaO) | 氧化物( )浸出率/% )浸出率/% | 产品中 纯度/% 纯度/% | 产品中Mg杂质含量/% (以  计) 计) | ||
 |  | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量) (M代表Ca或Mg)
(M代表Ca或Mg)ⅱ、
 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。①解释“浸钙”过程中主要浸出
 的原因是
的原因是②沉钙反应的离子方程式为
③“浸钙”过程不适宜选用
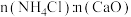 的比例为
的比例为④产品中
 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是(3)“浸镁”过程中,取固体B与一定浓度的
 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是(4)滤渣C中含有的物质是
(5)该流程中可循环利用的物质是
您最近一年使用:0次
2022-09-08更新
|
10104次组卷
|
14卷引用:北京交通大学附属中学2023-2024学年高三下学期开学考化学试题
北京交通大学附属中学2023-2024学年高三下学期开学考化学试题(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题15-19(已下线)北京市第四中学2022-2023学年高三上学期阶段测试2化学试题(已下线)2022年北京高考真题化学试题变式题(工业流程题)(已下线)第08讲 铝、镁及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)天津市耀华中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)易错点33 物质的制备-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
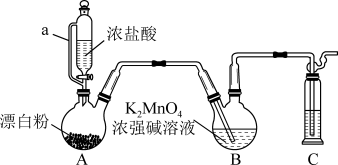
5 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
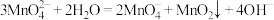
回答下列问题:
(1)装置A中a的作用是______________ ;装置C中的试剂为________________ ;装置A中制备Cl2的化学方程为______________ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________ 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________ (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________ (填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含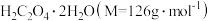 的质量分数表达式为
的质量分数表达式为_________________ 。
下列关于样品组成分析的说法,正确的是__________ (填标号)。
A.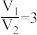 时,样品中一定不含杂质
时,样品中一定不含杂质
B.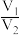 越大,样品中
越大,样品中 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
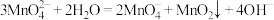
回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含
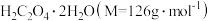 的质量分数表达式为
的质量分数表达式为下列关于样品组成分析的说法,正确的是
A.
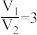 时,样品中一定不含杂质
时,样品中一定不含杂质B.
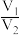 越大,样品中
越大,样品中 含量一定越高
含量一定越高C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
您最近一年使用:0次
2020-07-11更新
|
9248次组卷
|
27卷引用:北京市第二十中学2022-2023学年高三下学期开学检测化学试题
北京市第二十中学2022-2023学年高三下学期开学检测化学试题河南省三门峡市第一高级中学2021届高三8月开学考试化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题山东省济宁市实验中学2022届高三上学期开学考试化学试题山东省临沂市临沭第一中学2022届高三上学期开学考试化学试题2020年山东省高考化学试卷(新高考)(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编江西省高安中学2020-2021学年高二上学期第一次段考化学(A)试题黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题选择性必修1 专题3素养检测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省潍坊市第一中学2022届高三10月月考化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 化学综合实验 热点5 物质制备实验与定量测定实验(已下线)专题19 实验综合题
名校
解题方法
6 . 一种处理高浓度氨氮废水并获取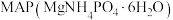 的工艺流程如下。
的工艺流程如下。 难溶于水,可溶于酸。
难溶于水,可溶于酸。
② 时水中的溶解性:
时水中的溶解性: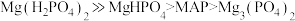 。
。
(1)下列说法正确的是___________ (填字母序号)。
a. 可用作复合肥
可用作复合肥
b.分离的方法可以是过滤
c.废水中的 会抑制
会抑制 水解
水解
(2)沉淀剂的选择。其他条件相同,按 投入相应的沉淀剂,其氨氮去除效果如图所示。
投入相应的沉淀剂,其氨氮去除效果如图所示。 的离子方程式为
的离子方程式为___________ 。
②ⅲ和i相比,ⅲ的氨氮去除率低,原因是___________ 。
③沉淀剂为ⅱ和ⅳ时,氨氮去除率明显低于其他相应组,原因是___________ 。
(3)用ⅰ作沉淀剂,研究其他条件相同时,不同 下氨氮去除效果和溶液中余磷含量,结果如下。
下氨氮去除效果和溶液中余磷含量,结果如下。 时的氨氮去除率略大于
时的氨氮去除率略大于 时的氨氮去除率,原因是:
时的氨氮去除率,原因是:
a.生成了 ;
;
b.___________ (结合方程式解释)。
② 后,氨氮去除率明显减小,原因是
后,氨氮去除率明显减小,原因是___________ 。
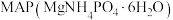 的工艺流程如下。
的工艺流程如下。
 难溶于水,可溶于酸。
难溶于水,可溶于酸。②
 时水中的溶解性:
时水中的溶解性: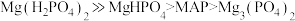 。
。(1)下列说法正确的是
a.
 可用作复合肥
可用作复合肥b.分离的方法可以是过滤
c.废水中的
 会抑制
会抑制 水解
水解(2)沉淀剂的选择。其他条件相同,按
 投入相应的沉淀剂,其氨氮去除效果如图所示。
投入相应的沉淀剂,其氨氮去除效果如图所示。
 的离子方程式为
的离子方程式为②ⅲ和i相比,ⅲ的氨氮去除率低,原因是
③沉淀剂为ⅱ和ⅳ时,氨氮去除率明显低于其他相应组,原因是
(3)用ⅰ作沉淀剂,研究其他条件相同时,不同
 下氨氮去除效果和溶液中余磷含量,结果如下。
下氨氮去除效果和溶液中余磷含量,结果如下。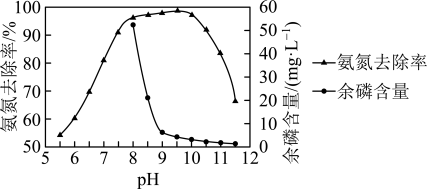
 时的氨氮去除率略大于
时的氨氮去除率略大于 时的氨氮去除率,原因是:
时的氨氮去除率,原因是:a.生成了
 ;
;b.
②
 后,氨氮去除率明显减小,原因是
后,氨氮去除率明显减小,原因是
您最近一年使用:0次
2023-05-07更新
|
506次组卷
|
3卷引用:北京市第一○一中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
7 . 自然界中的局部氮循环如下图。

(1)上图含氮物质的各步转化中,属于氮的固定的是______ ( 填数字序号)。
(2) NH3是氮循环中的重要物质,工业合成氨反应的化学方程式为_____________ 。
(3)某化工厂出现泄漏,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH发生波动,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是_____ ( 填字母序号)。
a.过量氨进入循环水后,水中NO 和NO
和NO 含量会升高
含量会升高
b.过量氨进入循环水后,不会导致水体富营养化
c.循环水pH的波动中,pH的上升与氨水的碱性有关
d.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c(NO )可判断循环水的水质是否恶化,c(NO
)可判断循环水的水质是否恶化,c(NO )检测利用的是酸性条件下I- 被NO
)检测利用的是酸性条件下I- 被NO 氧化为I2的反应,该反应的历程如下:
氧化为I2的反应,该反应的历程如下:
I. NO +2H+= NO++H2O
+2H+= NO++H2O
II. ……
III.2ONI= I2+2NO
II的离子方程式为___________ 。
(4)含NO 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14NO
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14NO + 5FeS2+
+ 5FeS2+___ H+ 7N2↑+10SO
7N2↑+10SO +
+___________

(1)上图含氮物质的各步转化中,属于氮的固定的是
(2) NH3是氮循环中的重要物质,工业合成氨反应的化学方程式为
(3)某化工厂出现泄漏,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH发生波动,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是
a.过量氨进入循环水后,水中NO
 和NO
和NO 含量会升高
含量会升高b.过量氨进入循环水后,不会导致水体富营养化
c.循环水pH的波动中,pH的上升与氨水的碱性有关
d.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c(NO
 )可判断循环水的水质是否恶化,c(NO
)可判断循环水的水质是否恶化,c(NO )检测利用的是酸性条件下I- 被NO
)检测利用的是酸性条件下I- 被NO 氧化为I2的反应,该反应的历程如下:
氧化为I2的反应,该反应的历程如下:I. NO
 +2H+= NO++H2O
+2H+= NO++H2OII. ……
III.2ONI= I2+2NO
II的离子方程式为
(4)含NO
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14NO
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14NO + 5FeS2+
+ 5FeS2+ 7N2↑+10SO
7N2↑+10SO +
+
您最近一年使用:0次
2020-11-06更新
|
454次组卷
|
5卷引用:北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题
解题方法
8 . 高锰酸钾是一种应用领域非常广泛的强氧化剂。实验室中可用K2MnO4歧化法或电解K2MnO4的方法制备高锰酸钾。
(1)K2MnO4歧化法制备高锰酸钾的流程如下图(部分不含锰元素的产物已略去)。

①操作1是____________ 。
②“熔融”过程中反应的化学方程式是____________ 。
③酸化时,理论上最高只有66.7%的锰元素转化为KMnO4,解释其原因:____________ 。
④已知:相关物质不同温度下的溶解度(单位:g)数据如表:
结晶法得到的粗KMnO4中一般含有少量KCl杂质。“酸化”时所用的酸也会影响其他杂质含量。为减少杂质含量,下列酸化时最适宜的物质是____________ 。
A.醋酸 B.CO2 C.硫酸
(2)电解K2MnO4溶液的方法制备高锰酸钾。
①KMnO4在____________ .(填“阴”或“阳”)极生成。
②研究表明:在恒定电流的条件下进行电解时,K2MnO4的转化率和电流效率(通过单位电量时KMnO4实际产量与理论产量之比)随时间的变化如图所示。

解释图中电流效率变化的原因____________ 。
(1)K2MnO4歧化法制备高锰酸钾的流程如下图(部分不含锰元素的产物已略去)。

①操作1是
②“熔融”过程中反应的化学方程式是
③酸化时,理论上最高只有66.7%的锰元素转化为KMnO4,解释其原因:
④已知:相关物质不同温度下的溶解度(单位:g)数据如表:
| KMnO4 | CH3COOK | K2SO4 | KCl | K2CO3 | KHCO3 | |
| 20℃ | 6.34. | 217 | 11.1 | 34.2 | 111 | 33.7 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
结晶法得到的粗KMnO4中一般含有少量KCl杂质。“酸化”时所用的酸也会影响其他杂质含量。为减少杂质含量,下列酸化时最适宜的物质是
A.醋酸 B.CO2 C.硫酸
(2)电解K2MnO4溶液的方法制备高锰酸钾。
①KMnO4在
②研究表明:在恒定电流的条件下进行电解时,K2MnO4的转化率和电流效率(通过单位电量时KMnO4实际产量与理论产量之比)随时间的变化如图所示。

解释图中电流效率变化的原因
您最近一年使用:0次
2020-09-09更新
|
115次组卷
|
2卷引用:北京市2021届高三上学期入学定位考试化学试题



