名校
解题方法
1 .  新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
(1) 的制备。
的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是______ 。
Ⅱ.上述反应适宜的温度范围是________ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有:___________ 、___________ 和 。
。
③碳热还原法。
以 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。
已知:i.
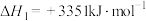
ii.
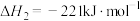
iii.
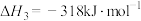
运用平衡移动原理分析反应ii对反应i的可能影响:___________ 。
(2) 的性质。
的性质。 粉末可发生水解的化学方程式是
粉末可发生水解的化学方程式是 。相同条件下,不同粒径的
。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
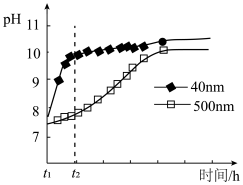
解释 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:___________ 。
(3) 含量检测。向
含量检测。向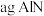 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的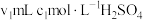 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是___________ 。
 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:| 物质 | 熔点/℃ | 沸点/℃ | 与 反应温度 /℃ 反应温度 /℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 |  :>2000(>1400升华) :>2000(>1400升华) :(>181升华) :(>181升华) |
| Mg | 649 | 1090 | >300 |  :>800 :>800 |
(1)
 的制备。
的制备。①化学气相沉积法。
Ⅰ.一定温度下,以
 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 。
。③碳热还原法。
以
 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。已知:i.

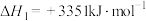
ii.

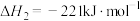
iii.

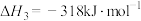
运用平衡移动原理分析反应ii对反应i的可能影响:
(2)
 的性质。
的性质。 粉末可发生水解的化学方程式是
粉末可发生水解的化学方程式是 。相同条件下,不同粒径的
。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
解释
 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:(3)
 含量检测。向
含量检测。向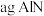 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的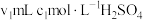 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是
您最近一年使用:0次
2 . 以废旧铅酸电池中的含铅废料( 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:
ii.
(1)溶浸
 均转化为
均转化为 。
。
①上述流程中能提高含铅废料中铅的浸出率的措施有_______ 。
② 转化为
转化为 的反应有:
的反应有: 、
、_______ 。
(2)结晶
①所得 中含有少量
中含有少量 ,原因是
,原因是_______ (用方程式表示)。
②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
循环3次后, 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入_____ (填试剂),过滤,滤液可再次参与循环。
(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。_______ 。
(4)测定废料中铅的含量
将 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数_______ 。
资料:滴定原理为:
 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:

ii.

(1)溶浸
 均转化为
均转化为 。
。①上述流程中能提高含铅废料中铅的浸出率的措施有
②
 转化为
转化为 的反应有:
的反应有: 、
、(2)结晶
①所得
 中含有少量
中含有少量 ,原因是
,原因是②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
 纯度/% 纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。
(4)测定废料中铅的含量
将
 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数资料:滴定原理为:

您最近一年使用:0次
2023-01-08更新
|
355次组卷
|
4卷引用:北京市铁路第二中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . 门捷列夫在研究周期表时预言了“类硅”元素锗和“类铝”元素镓等11种元素。锗及其化合物应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含 、
、 )的工艺如下:
)的工艺如下:

已知:i. 与碱反应生成
与碱反应生成 ;
; 与碱反应生成
与碱反应生成 。
。
ii. 极易水解生成
极易水解生成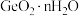 ;
; 沸点
沸点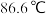 。
。
(1) 位于同主族
位于同主族 的下一周期,
的下一周期, 在周期表中的位置是
在周期表中的位置是_______ 。
(2)从原子结构角度解释金属性 比
比 强的原因
强的原因_______ 。
(3)“氧化”过程是将 氧化为
氧化为 ,其离子方程式为
,其离子方程式为_______ 。
(4)加盐酸蒸馏生成 ,生成
,生成 的化学方程式为
的化学方程式为_______ 。
(5)高纯二氧化锗的含量常采用碘酸钾 滴定法进行测定。步骤如下:
滴定法进行测定。步骤如下:
a.称取 高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成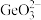
b.加入次亚磷酸钠溶液还原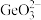 为
为
c.以淀粉为指示剂,用 的碘酸钾标准溶液滴定,当消耗碘酸钾溶液
的碘酸钾标准溶液滴定,当消耗碘酸钾溶液 时,溶液变蓝色,半分钟内溶液颜色不变。资料:
时,溶液变蓝色,半分钟内溶液颜色不变。资料: ;
;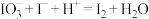 (未配平)。(
(未配平)。( 以下,次亚磷酸钠与
以下,次亚磷酸钠与 和
和 均不反应,
均不反应, 消耗的
消耗的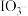 忽略不计)
忽略不计)
①配平离子方程式_______ 。

②此样品中二氧化锗的质量分数是_______ (用含w、c、V的数学表达式表示)。
 、
、 )的工艺如下:
)的工艺如下:
已知:i.
 与碱反应生成
与碱反应生成 ;
; 与碱反应生成
与碱反应生成 。
。ii.
 极易水解生成
极易水解生成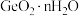 ;
; 沸点
沸点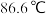 。
。(1)
 位于同主族
位于同主族 的下一周期,
的下一周期, 在周期表中的位置是
在周期表中的位置是(2)从原子结构角度解释金属性
 比
比 强的原因
强的原因(3)“氧化”过程是将
 氧化为
氧化为 ,其离子方程式为
,其离子方程式为(4)加盐酸蒸馏生成
 ,生成
,生成 的化学方程式为
的化学方程式为(5)高纯二氧化锗的含量常采用碘酸钾
 滴定法进行测定。步骤如下:
滴定法进行测定。步骤如下:a.称取
 高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成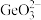
b.加入次亚磷酸钠溶液还原
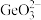 为
为
c.以淀粉为指示剂,用
 的碘酸钾标准溶液滴定,当消耗碘酸钾溶液
的碘酸钾标准溶液滴定,当消耗碘酸钾溶液 时,溶液变蓝色,半分钟内溶液颜色不变。资料:
时,溶液变蓝色,半分钟内溶液颜色不变。资料: ;
;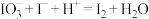 (未配平)。(
(未配平)。( 以下,次亚磷酸钠与
以下,次亚磷酸钠与 和
和 均不反应,
均不反应, 消耗的
消耗的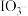 忽略不计)
忽略不计)①配平离子方程式

②此样品中二氧化锗的质量分数是
您最近一年使用:0次
2022-05-01更新
|
430次组卷
|
2卷引用:北京市清华大学附属中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
4 . Ⅰ.为测定金属钠样品(表面有 )中钠单质的质置分数,设计了如下实验(反应装置如图所示).
)中钠单质的质置分数,设计了如下实验(反应装置如图所示).
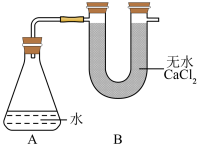
①称量 的总质量;
的总质量;
②称取一定质量的钠样品:
③将钠样品投入锥形瓶中,迅速塞紧带 形干燥管(内含无水
形干燥管(内含无水 干燥剂)的橡皮塞.
干燥剂)的橡皮塞.
有关数据:
称取的金属钠样品质最为 ,加入金属钠之前装置
,加入金属钠之前装置 的总质量为
的总质量为 ,反应结束后装置
,反应结束后装置 的总质量为
的总质量为 .
.
请根据题意回答下列问题.
(1) 中钠和水反应的离子方程式为
中钠和水反应的离子方程式为____________________________
(2)用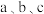 表示钠单质的质量分数为
表示钠单质的质量分数为______________ .
(3)如果没有B装置,对实验结果有何影响______________ (填“偏大”“偏小”或“无影响”).
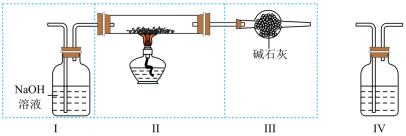
Ⅱ.现用金属钠和空气制备纯度较高的 ,可利用的装置如下图.
,可利用的装置如下图.
回答下列问题.
(4)上述装置Ⅰ的作用是______________ .
(5)上述装置Ⅳ盛放的试剂是______________,为完成实验应将装置Ⅳ接在______________(填字).
 )中钠单质的质置分数,设计了如下实验(反应装置如图所示).
)中钠单质的质置分数,设计了如下实验(反应装置如图所示).
①称量
 的总质量;
的总质量;②称取一定质量的钠样品:
③将钠样品投入锥形瓶中,迅速塞紧带
 形干燥管(内含无水
形干燥管(内含无水 干燥剂)的橡皮塞.
干燥剂)的橡皮塞.有关数据:
称取的金属钠样品质最为
 ,加入金属钠之前装置
,加入金属钠之前装置 的总质量为
的总质量为 ,反应结束后装置
,反应结束后装置 的总质量为
的总质量为 .
.请根据题意回答下列问题.
(1)
 中钠和水反应的离子方程式为
中钠和水反应的离子方程式为(2)用
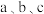 表示钠单质的质量分数为
表示钠单质的质量分数为(3)如果没有B装置,对实验结果有何影响
Ⅱ.现用金属钠和空气制备纯度较高的
 ,可利用的装置如下图.
,可利用的装置如下图.
回答下列问题.
(4)上述装置Ⅰ的作用是
(5)上述装置Ⅳ盛放的试剂是______________,为完成实验应将装置Ⅳ接在______________(填字).
| A.Ⅰ之前 | B.Ⅰ和Ⅱ之间 | C.Ⅱ和Ⅲ之间 | D.Ⅲ之后 |
您最近一年使用:0次
名校
5 . 过氧化钙(CaO2)微溶于水,可作医用防腐剂、消毒剂,以下是制备CaO2的一种方法。

回答下列问题:
(1)步骤Ⅰ中反应的离子方程式是___________ 。
(2)步骤Ⅱ中反应的化学方程式是:___________ = CaO2·8H2O↓ + 2NH4Cl,反应在冰水浴中进行,是为了防止NH3·H2O挥发、___________ (答1条即可)。
(3)待CaO2·8H2O固体结晶析出后通过___________ (填操作)分离。
(4)CaO2中阴阳离子的个数比为___________ ,其与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是___________ 。CaO2还可用于长途运输鱼苗,这体现了CaO2的___________ (填字母)性质。
a.可缓慢供氧 b.能吸收鱼苗呼出的CO2 c.能潮解 d.可抑菌
(5)CaO2久置于空气中会生成CaCO3.为测定某CaO2样品的纯度,取10 g样品加入足量稀盐酸,测得生成CO2的质量为2.2 g,则样品中CaO2的质量分数为___________ 。

回答下列问题:
(1)步骤Ⅰ中反应的离子方程式是
(2)步骤Ⅱ中反应的化学方程式是:
(3)待CaO2·8H2O固体结晶析出后通过
(4)CaO2中阴阳离子的个数比为
a.可缓慢供氧 b.能吸收鱼苗呼出的CO2 c.能潮解 d.可抑菌
(5)CaO2久置于空气中会生成CaCO3.为测定某CaO2样品的纯度,取10 g样品加入足量稀盐酸,测得生成CO2的质量为2.2 g,则样品中CaO2的质量分数为
您最近一年使用:0次
2024-01-25更新
|
160次组卷
|
3卷引用:北京市第十三中学2023-2024学年高一上学期期中考试化学(选考班)试题
解题方法
6 . 以钛铁矿(主要含 钛元素化合价为+4)为原料制备铵铁蓝
钛元素化合价为+4)为原料制备铵铁蓝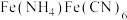 的一种流程示意图如下。
的一种流程示意图如下。
已知:钛铁铁矿遇酸以 形式存在于溶液中,且易水解为
形式存在于溶液中,且易水解为

(1)钛铁矿粉碎的目的是___________ 。
(2)请结合化学用语解释向酸浸液中加入“生铁”的目的是___________ 。
(3)滤渣中的主要成分是___________ 。
(4)在“沉铁”步骤产生的白色沉淀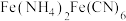 ,
,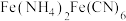 中Fe的化合价是
中Fe的化合价是___________ 。
(5)流程中 的作用是
的作用是___________ ,该步发生反应的离子方程式是___________ 。
(6)铵铁蓝溶液的颜色受铵铁蓝溶液中游离 时的质量分数影响,
时的质量分数影响, 的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中
的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中 的质量分数受条件影响如下图所示:
的质量分数受条件影响如下图所示:

 浓度对
浓度对 质量分数的影响
质量分数的影响

“沉铁”步骤中混合溶液pH对 质量分数的影响
质量分数的影响
要得到颜色鲜艳的铵铁蓝还需控制的条件是___________ 。
 钛元素化合价为+4)为原料制备铵铁蓝
钛元素化合价为+4)为原料制备铵铁蓝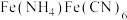 的一种流程示意图如下。
的一种流程示意图如下。已知:钛铁铁矿遇酸以
 形式存在于溶液中,且易水解为
形式存在于溶液中,且易水解为

(1)钛铁矿粉碎的目的是
(2)请结合化学用语解释向酸浸液中加入“生铁”的目的是
(3)滤渣中的主要成分是
(4)在“沉铁”步骤产生的白色沉淀
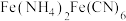 ,
,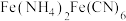 中Fe的化合价是
中Fe的化合价是(5)流程中
 的作用是
的作用是(6)铵铁蓝溶液的颜色受铵铁蓝溶液中游离
 时的质量分数影响,
时的质量分数影响, 的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中
的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中 的质量分数受条件影响如下图所示:
的质量分数受条件影响如下图所示:
 浓度对
浓度对 质量分数的影响
质量分数的影响
“沉铁”步骤中混合溶液pH对
 质量分数的影响
质量分数的影响要得到颜色鲜艳的铵铁蓝还需控制的条件是
您最近一年使用:0次
名校
7 . KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
I.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融物。
II.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
III.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
IV.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)I中,软锰矿(主要成分MnO2)提纯后可用于实验室制取氯气,反应的离子方程式为:_______ 。
(2)I中,生成K2MnO4的化学方程式是_______ 。
(3)II中,浸取时用稀KOH溶液的原因是_______ 。
(4)III中,CO2和K2MnO4在溶液中反应的化学方程式是_______ 。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如下图:

a极发生_______ (填“氧化”或“还原”)反应;判断依据是:_______ 。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:

摩尔质量: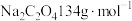
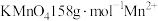 颜色为肉粉色
颜色为肉粉色
i.称取a g产品,配成50mL溶液。
ii.称取bg Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
iii.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至_______ (填现象),消耗溶液VmL(杂质不参与反应)。则产品中KMnO4的质量分数的表达式为:_______ 。
I.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融物。
II.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
III.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
IV.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)I中,软锰矿(主要成分MnO2)提纯后可用于实验室制取氯气,反应的离子方程式为:
(2)I中,生成K2MnO4的化学方程式是
(3)II中,浸取时用稀KOH溶液的原因是
(4)III中,CO2和K2MnO4在溶液中反应的化学方程式是
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如下图:

a极发生
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:


摩尔质量:
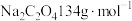
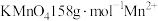 颜色为肉粉色
颜色为肉粉色i.称取a g产品,配成50mL溶液。
ii.称取bg Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
iii.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至
您最近一年使用:0次
名校
解题方法
8 . 氯化钴(CoCl2)在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。
(1)某钴矿石的主要成分包括CoO、MnO、Fe2O3和SiO2。由该矿石制CoCl2•6H2O固体的方法如图(部分分离操作省略):

资料:Mn2+生成Mn(OH)2,开始沉淀时pH=8.2,完全沉淀时pH=10.2。
①上述矿石溶解过程中,采取加快化学反应速率的措施有_____ (写出一条即可)。
②CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括H+、Mn2+和_____ 。
③已知pH=2.8时溶液中Fe3+完全沉淀。沉淀2是_____ 。
④溶液2中含有Co2+和Mn2+。
i.已知:25℃时Ksp[Co(OH)2]≈1×10-15,当c(Co2+)<1×10-5mol•L-1时可认为Co2+完全沉淀。若向溶液2中加入碱溶液,常温下,当pH=_____ 时Co2+完全沉淀。由此可知,通过调节pH无法将Mn2+和Co2+完全分离。
ii.溶液2中加入H2O2溶液的离子方程为_____ 。
⑤由溶液3得到CoCl2•6H2O的操作为_____ 。
(2)可用如下方法测定产品中CoCl2•6H2O的质量分数(其他杂质不干扰测定):
资料:
i.M(CoCl2•6H2O)=238g•mol-1。
ii.Co2+与SCN-反应生成蓝色的Co(SCN) ;Co2+与EDTA以物质的量比1:1反应,得到红色溶液;后者的反应程度大于前者。取mg产品溶于水,向其中滴加几滴KSCN溶液作指示剂。再用cmol•L-1EDTA溶液滴定,消耗EDTA溶液的体积为vmL,产品中CoCl2•6H2O的质量分数为
;Co2+与EDTA以物质的量比1:1反应,得到红色溶液;后者的反应程度大于前者。取mg产品溶于水,向其中滴加几滴KSCN溶液作指示剂。再用cmol•L-1EDTA溶液滴定,消耗EDTA溶液的体积为vmL,产品中CoCl2•6H2O的质量分数为_____ (结果用m、v、c表示)。
(1)某钴矿石的主要成分包括CoO、MnO、Fe2O3和SiO2。由该矿石制CoCl2•6H2O固体的方法如图(部分分离操作省略):

资料:Mn2+生成Mn(OH)2,开始沉淀时pH=8.2,完全沉淀时pH=10.2。
①上述矿石溶解过程中,采取加快化学反应速率的措施有
②CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括H+、Mn2+和
③已知pH=2.8时溶液中Fe3+完全沉淀。沉淀2是
④溶液2中含有Co2+和Mn2+。
i.已知:25℃时Ksp[Co(OH)2]≈1×10-15,当c(Co2+)<1×10-5mol•L-1时可认为Co2+完全沉淀。若向溶液2中加入碱溶液,常温下,当pH=
ii.溶液2中加入H2O2溶液的离子方程为
⑤由溶液3得到CoCl2•6H2O的操作为
(2)可用如下方法测定产品中CoCl2•6H2O的质量分数(其他杂质不干扰测定):
资料:
i.M(CoCl2•6H2O)=238g•mol-1。
ii.Co2+与SCN-反应生成蓝色的Co(SCN)
 ;Co2+与EDTA以物质的量比1:1反应,得到红色溶液;后者的反应程度大于前者。取mg产品溶于水,向其中滴加几滴KSCN溶液作指示剂。再用cmol•L-1EDTA溶液滴定,消耗EDTA溶液的体积为vmL,产品中CoCl2•6H2O的质量分数为
;Co2+与EDTA以物质的量比1:1反应,得到红色溶液;后者的反应程度大于前者。取mg产品溶于水,向其中滴加几滴KSCN溶液作指示剂。再用cmol•L-1EDTA溶液滴定,消耗EDTA溶液的体积为vmL,产品中CoCl2•6H2O的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 软锰矿浆(主要成分 )可吸收烟气中的
)可吸收烟气中的 ,同时可制备
,同时可制备 ,工艺流程如下:
,工艺流程如下:

资料:①吸收 后的软锰矿浆中含有
后的软锰矿浆中含有 、
、 、
、 、
、 等阳离子;
等阳离子;
②金属离子沉淀的pH如下表。
(1)脱硫的产物是 ,软锰矿中
,软锰矿中 所起的作用是
所起的作用是___________ 。
(2)过程1向浆液中通入 的目的是
的目的是___________ 。
(3)滤渣1的成分是___________ ,过程2中发生反应的离子方程式为___________ 。
(4)制备 的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是
的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是___________ 。
(5)已知:常温下, 溶液的pH约为9.3,
溶液的pH约为9.3, 溶液的pH约为7.8.请推测物质A,并写出制备
溶液的pH约为7.8.请推测物质A,并写出制备 时发生反应的离子方程式:
时发生反应的离子方程式:___________ 。
(6)取m g碳酸锰样品,加适量硫酸加热溶解后,用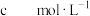 的
的 溶液滴定,至滴定终点时,消耗
溶液滴定,至滴定终点时,消耗 溶液的体积为
溶液的体积为 。(已知:反应产物为
。(已知:反应产物为 ,杂质不参与反应),样品中
,杂质不参与反应),样品中 质量分数的计算式为
质量分数的计算式为___________ (用质量分数表示)。
 )可吸收烟气中的
)可吸收烟气中的 ,同时可制备
,同时可制备 ,工艺流程如下:
,工艺流程如下:
资料:①吸收
 后的软锰矿浆中含有
后的软锰矿浆中含有 、
、 、
、 、
、 等阳离子;
等阳离子;②金属离子沉淀的pH如下表。
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 8.2 |
(1)脱硫的产物是
 ,软锰矿中
,软锰矿中 所起的作用是
所起的作用是(2)过程1向浆液中通入
 的目的是
的目的是(3)滤渣1的成分是
(4)制备
 的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是
的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是(5)已知:常温下,
 溶液的pH约为9.3,
溶液的pH约为9.3, 溶液的pH约为7.8.请推测物质A,并写出制备
溶液的pH约为7.8.请推测物质A,并写出制备 时发生反应的离子方程式:
时发生反应的离子方程式:(6)取m g碳酸锰样品,加适量硫酸加热溶解后,用
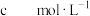 的
的 溶液滴定,至滴定终点时,消耗
溶液滴定,至滴定终点时,消耗 溶液的体积为
溶液的体积为 。(已知:反应产物为
。(已知:反应产物为 ,杂质不参与反应),样品中
,杂质不参与反应),样品中 质量分数的计算式为
质量分数的计算式为
您最近一年使用:0次
2021-11-04更新
|
437次组卷
|
5卷引用:北京市海淀区2021-2022学年高三上学期期中考试化学试题
名校
10 . 溴酸钾(KBrO3)可用于测定水体中的砷含量。
(1)KBrO3的一种制法如下。

① Br2与KOH溶液反应时,若产生1 mol KBrO3,理论上需要_______ mol Br2。
② Cl2能提高溴的原子利用率。用离子方程式表示Cl2的作用:_______ 。
③ 已知: 25 ℃时的溶度积(Ksp)
设计由“含KBrO3的溶液”到“较纯净的KBrO3溶液”的流程:_______ (按如图形式呈现,箭头上方注明试剂,下方注明操作,
如 )。
)。
(2)测定水体中亚砷酸盐(AsO )的含量:取a mL水样,向其中加入一定量盐酸使AsO
)的含量:取a mL水样,向其中加入一定量盐酸使AsO 转化为H3AsO3,再加入2滴甲基橙指示剂和一定量KBr,用c mol·L−1 KBrO3溶液进行滴定,达到滴定终点时,消耗KBrO3溶液v mL。滴定过程中发生如下反应:
转化为H3AsO3,再加入2滴甲基橙指示剂和一定量KBr,用c mol·L−1 KBrO3溶液进行滴定,达到滴定终点时,消耗KBrO3溶液v mL。滴定过程中发生如下反应:
反应a:3H3AsO3 + BrO = 3H3AsO4 + Br-
= 3H3AsO4 + Br-
反应b:BrO + 5Br- + 6H+ = 3Br2 + 3H2O
+ 5Br- + 6H+ = 3Br2 + 3H2O
当H3AsO3反应完全后,甲基橙与生成的Br2反应而褪色,即达到滴定终点。
①配制一定物质的量浓度的KBrO3溶液,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和_______ 。
②水样中AsO 的含量为
的含量为_______ g·L−1【已知:M(AsO )=123 g·mol−1】
)=123 g·mol−1】
③滴定过程需保持在60 ℃。若温度过低,甲基橙与Br2的反应速率较慢,会使测定结果_______ (填“偏高”或“偏低”)。
(1)KBrO3的一种制法如下。

① Br2与KOH溶液反应时,若产生1 mol KBrO3,理论上需要
② Cl2能提高溴的原子利用率。用离子方程式表示Cl2的作用:
③ 已知: 25 ℃时的溶度积(Ksp)
| Ba(BrO3)2 | BaCO3 | |
| Ksp | 2.4×10-4 | 2.6×10-9 |
如
 )。
)。(2)测定水体中亚砷酸盐(AsO
 )的含量:取a mL水样,向其中加入一定量盐酸使AsO
)的含量:取a mL水样,向其中加入一定量盐酸使AsO 转化为H3AsO3,再加入2滴甲基橙指示剂和一定量KBr,用c mol·L−1 KBrO3溶液进行滴定,达到滴定终点时,消耗KBrO3溶液v mL。滴定过程中发生如下反应:
转化为H3AsO3,再加入2滴甲基橙指示剂和一定量KBr,用c mol·L−1 KBrO3溶液进行滴定,达到滴定终点时,消耗KBrO3溶液v mL。滴定过程中发生如下反应:反应a:3H3AsO3 + BrO
 = 3H3AsO4 + Br-
= 3H3AsO4 + Br-反应b:BrO
 + 5Br- + 6H+ = 3Br2 + 3H2O
+ 5Br- + 6H+ = 3Br2 + 3H2O当H3AsO3反应完全后,甲基橙与生成的Br2反应而褪色,即达到滴定终点。
①配制一定物质的量浓度的KBrO3溶液,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
②水样中AsO
 的含量为
的含量为 )=123 g·mol−1】
)=123 g·mol−1】③滴定过程需保持在60 ℃。若温度过低,甲基橙与Br2的反应速率较慢,会使测定结果
您最近一年使用:0次



