1 . 化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:
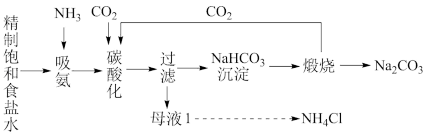
(1)实验室通常用石灰石和稀盐酸制备 ,为使产品纯净,需将制得的
,为使产品纯净,需将制得的 净化,可以将制得的
净化,可以将制得的 先通过饱和
先通过饱和_____ (填化学式)溶液,以除去混有的HCl杂质。
(2)循环使用的物质是_____ ,主要目的是_____ 。
(3)工艺流程中碳酸化时发生反应的化学方程式为_____ 。
(4)制得的纯碱中含有少量NaCl。请设计实验方案检验NaCl的存在:_____ 。
(5)产品分析:把5.8g含有少量NaCl杂质的 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g。
增重1.4g。
①气体与 反应的化学方程式为
反应的化学方程式为_____ ;
②产品纯度为_____ (用百分数表示,保留到小数点后1位)。
(6)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定产品中碳酸氢钠的质量分数。加热质量为 的该产品,最终测得剩余固体质量为
的该产品,最终测得剩余固体质量为 。则产品中碳酸氢钠的质量百分数可表示为
。则产品中碳酸氢钠的质量百分数可表示为_____ (用字母 和
和 表示)。
表示)。

(1)实验室通常用石灰石和稀盐酸制备
 ,为使产品纯净,需将制得的
,为使产品纯净,需将制得的 净化,可以将制得的
净化,可以将制得的 先通过饱和
先通过饱和(2)循环使用的物质是
(3)工艺流程中碳酸化时发生反应的化学方程式为
(4)制得的纯碱中含有少量NaCl。请设计实验方案检验NaCl的存在:
(5)产品分析:把5.8g含有少量NaCl杂质的
 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g。
增重1.4g。①气体与
 反应的化学方程式为
反应的化学方程式为②产品纯度为
(6)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定产品中碳酸氢钠的质量分数。加热质量为
 的该产品,最终测得剩余固体质量为
的该产品,最终测得剩余固体质量为 。则产品中碳酸氢钠的质量百分数可表示为
。则产品中碳酸氢钠的质量百分数可表示为 和
和 表示)。
表示)。
您最近一年使用:0次
名校
解题方法
2 . 山大附中化学实验兴趣小组制备高铁酸钾(K2FeO4)并探究其性质和纯度分析。
资料:K2FeO4为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
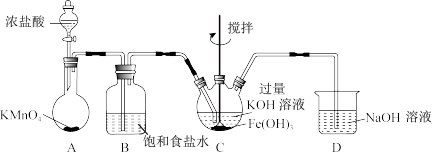
①A为氯气发生装置。A中反应离子方程式是___________ 。
②仪器C的名称为___________ 。反应时C的控温20~25℃,温度不能高于25℃的主要原因___________ 。C中得到紫色固体和溶液。写出C中反应生成K2FeO4的化学方程式___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl﹣而产生Cl2,设计以下方案:
i.由方案1中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定K2FeO4将Cl﹣氧化,还可能由___________ 产生(用离子方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl﹣。用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(3)K2FeO4的纯度分析
将1.32 g样品与过量的的KI溶液 (硫酸酸化)充分反应(杂质不参与反应)后配成100 mL溶液,每次取10.00 mL用0.1000 mol·L-1的Na2S2O3标准溶液滴定,三次滴定消耗Na2S2O3标准溶液体积平均为19.20 mL,则原样品中高铁酸钾的质量分数为___________ 。已知:I2+2Na2S2O3=2NaI+ Na2S4O6
资料:K2FeO4为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应离子方程式是
②仪器C的名称为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl﹣而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
ii.方案Ⅱ可证明K2FeO4氧化了Cl﹣。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(3)K2FeO4的纯度分析
将1.32 g样品与过量的的KI溶液 (硫酸酸化)充分反应(杂质不参与反应)后配成100 mL溶液,每次取10.00 mL用0.1000 mol·L-1的Na2S2O3标准溶液滴定,三次滴定消耗Na2S2O3标准溶液体积平均为19.20 mL,则原样品中高铁酸钾的质量分数为
您最近一年使用:0次
2021-12-04更新
|
163次组卷
|
2卷引用:山西大学附属中学校2021-2022学年高三上学期期中考试化学试题
3 . 叠氮化钠(NaN3)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊的药剂等。氨基钠(NaNH2)的熔点为210℃,沸点为400℃,在水溶液中易水解。实验室制取叠氮化钠的实验步骤及实验装置如下:
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
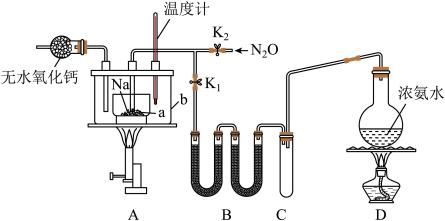
回答下列问题:
(1)装置B中盛放的药品为____________ 。
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为__________ 。
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为__________ ;生成NaN3的化学方程式为__________ ;N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则应选择的气体发生装置是_____________ (填序号)。

(4)步骤④中用乙醚洗涤的主要目的是______________ 。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为_______________ 。
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

回答下列问题:
(1)装置B中盛放的药品为
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为

(4)步骤④中用乙醚洗涤的主要目的是
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 钼酸钠( Na2MoO4 )是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。

回答下列问题:
(1)若想提高钼精矿焙烧的速率,可采取的措施有__________ 。 任写一种即可)
(2)如果在空气中焙烧 l mol MoS2时,S 转移12mol 电子,则发生反应的化学方程式为______________________________ ;焙烧产生的尾气对环境的主要危害是__________________________________ 。
(3)钼精矿中 MoS2含量的测定:取钼精矿 160g( 假设杂质不与空气反应),经在空气中焙烧 若在焙烧过程中产生的尾气用过量的浓氨水吸收,则需要质量分数为 40%,密度为 0.85g • cm-3的氨水 150mL。(假设各步的转化率均为 100%) , 则 MoS2的百分含量为________________ 。(已知MoS2的相对分子质量为160)。
(4)操作 3 硫元素被氧化为最高价,发生反应的离子方程式为__________ 。
(5)用镍、钼作电极电解浓 NaOH溶液制备钼酸钠( Na2MoO4)的装置如图 1 所示。b电极上的电极反应式为____________________ 。

(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图 2 所示,该温度下BaMoO4的Ksp的值为_____________ 。

回答下列问题:
(1)若想提高钼精矿焙烧的速率,可采取的措施有
(2)如果在空气中焙烧 l mol MoS2时,S 转移12mol 电子,则发生反应的化学方程式为
(3)钼精矿中 MoS2含量的测定:取钼精矿 160g( 假设杂质不与空气反应),经在空气中焙烧 若在焙烧过程中产生的尾气用过量的浓氨水吸收,则需要质量分数为 40%,密度为 0.85g • cm-3的氨水 150mL。(假设各步的转化率均为 100%) , 则 MoS2的百分含量为
(4)操作 3 硫元素被氧化为最高价,发生反应的离子方程式为
(5)用镍、钼作电极电解浓 NaOH溶液制备钼酸钠( Na2MoO4)的装置如图 1 所示。b电极上的电极反应式为

(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图 2 所示,该温度下BaMoO4的Ksp的值为
您最近一年使用:0次
真题
名校
5 . 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
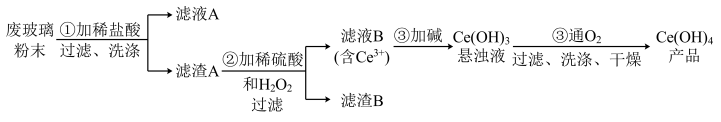
(1)洗涤滤渣A的目的是为了去除_______ (填离子符号),检验该离子是否洗涤的方法是_________________________________________________________ 。
(2)第②步反应的离子方程式是______________________________ ,滤渣B的主要成分是_________ 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________ (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有_________ 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为__________ 。

(1)洗涤滤渣A的目的是为了去除
(2)第②步反应的离子方程式是
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
2019-01-30更新
|
1513次组卷
|
9卷引用:山西省太原市第二十一中学2020届高三上学期期中考试化学试题
山西省太原市第二十一中学2020届高三上学期期中考试化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(安徽卷)(已下线)2012-2013学年河南省唐河县第一高级中学高一下第四次月考化学试卷(已下线)2014年高考化学指导冲关 第11练化学实验基础知识练习卷(已下线)2014届广东省广雅、金山、佛山一中等高三下学期2月联考理综化学试卷2017届山东省潍坊市实验中学高三下学期第四次单元过关测试理科综合化学试卷四川省成都市龙泉第二中学2019届高三9月月考化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题2上海市交大附中高三2019-2020学年化学寒假自我反馈
名校
解题方法
6 . 高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:

(1)装置I中盛放浓盐酸的仪器名称是___________ 。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________ 。
(3)装置Ⅱ中的试剂X的作用___________ 。
(4)上述炭置按气流由左至右各接口顺序为___________ (用字母表示)。
(5)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析出高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________ 。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________ 。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O;KIO4+7KI+8CH3COOH===4I2+8CH3COOK+4H2O;I2+2Na2S2O3===2NaI+N2S4O6则该产品中KIO4的百分含量是___________ (Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。

(1)装置I中盛放浓盐酸的仪器名称是
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是
(3)装置Ⅱ中的试剂X的作用
(4)上述炭置按气流由左至右各接口顺序为
(5)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析出高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O;KIO4+7KI+8CH3COOH===4I2+8CH3COOK+4H2O;I2+2Na2S2O3===2NaI+N2S4O6则该产品中KIO4的百分含量是
您最近一年使用:0次
7 . 亚氯酸钠(NaClO2)是一种高效内氧化剂、漂白剂,其有效氯含量相当于漂白粉的7倍,主要用于棉纺、造纸业的漂白制,也用于食品消毒。水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:

已知:①亚氯酸钠(NaClO2)受热易分解;
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
③ClO2常温下为黄绿色气体,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10% 以下更安全。
回答下列问题:
(1)在ClO2发生器中通入空气的作用是__________
(2)吸收塔中发生反应的化学方程式为:__________
(3)由滤液 NaClO2·3H2O,需采取的操作是在55C的条件下减压蒸发、
NaClO2·3H2O,需采取的操作是在55C的条件下减压蒸发、_______ 、_______ 洗涤、干燥。工业上通常采用“减压蒸发”而不用“常压蒸发”,原因是_______ ;结晶后需要对晶体洗涤,为了减少损失,可以用______ 洗涤晶体。
(4)在碱性溶液中NaClO2比较稳定,在酸性溶液中, ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,试写出HClO2分解的化学方程式___________ 。

已知:①亚氯酸钠(NaClO2)受热易分解;
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
③ClO2常温下为黄绿色气体,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10% 以下更安全。
回答下列问题:
(1)在ClO2发生器中通入空气的作用是
(2)吸收塔中发生反应的化学方程式为:
(3)由滤液
 NaClO2·3H2O,需采取的操作是在55C的条件下减压蒸发、
NaClO2·3H2O,需采取的操作是在55C的条件下减压蒸发、(4)在碱性溶液中NaClO2比较稳定,在酸性溶液中, ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,试写出HClO2分解的化学方程式
您最近一年使用:0次



