名校
1 . 硫酸氧钒( )是工业生产钒电池的最重要原料,实验室制备
)是工业生产钒电池的最重要原料,实验室制备 晶体并测定钒含量的实验如下:
晶体并测定钒含量的实验如下:
(1) 晶体制备
晶体制备
实验室一般用浓硫酸与 共热反应,然后再加还原剂,即可得到
共热反应,然后再加还原剂,即可得到 晶体,反应装置如图(夹持及加热装置已省略)。
晶体,反应装置如图(夹持及加热装置已省略)。

仪器b的名称为________ ,仪器c的作用为_______ 。
(2)高锰酸钾标准滴定溶液的配制和标定
称取一定质量 溶于水中,稀释至1L,将溶液加热至沸(保持微沸1h),放置2天,过滤,除去析出的二氧化锰,滤液移入棕色瓶中;取一定体积配制好的
溶于水中,稀释至1L,将溶液加热至沸(保持微沸1h),放置2天,过滤,除去析出的二氧化锰,滤液移入棕色瓶中;取一定体积配制好的 溶液于锥形瓶中,加入适量水和稀硫酸,用
溶液于锥形瓶中,加入适量水和稀硫酸,用 标准溶液滴定至终点,经计算
标准溶液滴定至终点,经计算 标准滴定溶液浓度为
标准滴定溶液浓度为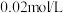 。
。
①配制高锰酸钾标准滴定溶液时,所用到的玻璃仪器有烧杯、试剂瓶、玻璃棒、______ 。
②加热微沸、放置2天的原因是___________ 。
③滴定酸性 标准溶液时的离子方程式为
标准溶液时的离子方程式为___________ 。
(3)硫酸氧钒样品的滴定
称取0.4000g干燥后硫酸氧钒样品,溶解,用 标准滴定溶液滴定至终点,滴定过程中
标准滴定溶液滴定至终点,滴定过程中 被氧化为
被氧化为 ,做3次平行实验,平均消耗
,做3次平行实验,平均消耗 标准液26.00mL,同时做空白实验,平均消耗高锰酸钾标准液2.00mL。
标准液26.00mL,同时做空白实验,平均消耗高锰酸钾标准液2.00mL。
①高锰酸钾标准溶液滴定硫酸氧钒时,滴定终点的现象是______ 。
②该样品中钒(Ⅳ)质量分数(以硫酸氧钒计)=______ (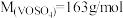 )。
)。
③实验过程中,下列操作会导致所测钒含量偏高的是______ 。
A.未做空白实验
B.滴定结束时俯视刻度线
C.滴定前滴定管有气泡,滴定结束后发现滴定管无气泡
D.盛装高锰酸钾标准液的滴定管未润洗
 )是工业生产钒电池的最重要原料,实验室制备
)是工业生产钒电池的最重要原料,实验室制备 晶体并测定钒含量的实验如下:
晶体并测定钒含量的实验如下:(1)
 晶体制备
晶体制备实验室一般用浓硫酸与
 共热反应,然后再加还原剂,即可得到
共热反应,然后再加还原剂,即可得到 晶体,反应装置如图(夹持及加热装置已省略)。
晶体,反应装置如图(夹持及加热装置已省略)。
仪器b的名称为
(2)高锰酸钾标准滴定溶液的配制和标定
称取一定质量
 溶于水中,稀释至1L,将溶液加热至沸(保持微沸1h),放置2天,过滤,除去析出的二氧化锰,滤液移入棕色瓶中;取一定体积配制好的
溶于水中,稀释至1L,将溶液加热至沸(保持微沸1h),放置2天,过滤,除去析出的二氧化锰,滤液移入棕色瓶中;取一定体积配制好的 溶液于锥形瓶中,加入适量水和稀硫酸,用
溶液于锥形瓶中,加入适量水和稀硫酸,用 标准溶液滴定至终点,经计算
标准溶液滴定至终点,经计算 标准滴定溶液浓度为
标准滴定溶液浓度为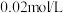 。
。①配制高锰酸钾标准滴定溶液时,所用到的玻璃仪器有烧杯、试剂瓶、玻璃棒、
②加热微沸、放置2天的原因是
③滴定酸性
 标准溶液时的离子方程式为
标准溶液时的离子方程式为(3)硫酸氧钒样品的滴定
称取0.4000g干燥后硫酸氧钒样品,溶解,用
 标准滴定溶液滴定至终点,滴定过程中
标准滴定溶液滴定至终点,滴定过程中 被氧化为
被氧化为 ,做3次平行实验,平均消耗
,做3次平行实验,平均消耗 标准液26.00mL,同时做空白实验,平均消耗高锰酸钾标准液2.00mL。
标准液26.00mL,同时做空白实验,平均消耗高锰酸钾标准液2.00mL。①高锰酸钾标准溶液滴定硫酸氧钒时,滴定终点的现象是
②该样品中钒(Ⅳ)质量分数(以硫酸氧钒计)=
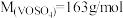 )。
)。③实验过程中,下列操作会导致所测钒含量偏高的是
A.未做空白实验
B.滴定结束时俯视刻度线
C.滴定前滴定管有气泡,滴定结束后发现滴定管无气泡
D.盛装高锰酸钾标准液的滴定管未润洗
您最近一年使用:0次
名校
2 . 实验室可通过反应;3Cl2+6KOH 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。

请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_______________________________ 。
(2)请分析装置图,进行补充和完善。A部分缺___________ 装置,B部分还应补充____________ 装置,还有一处设计明显不合理的是___________ (填“A”“B”或“C”)
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:______________________________________ 。
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______________ ;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________ (不考虑Cl2的挥发)

(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 mol•L-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 mol•L-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为_________ 。(已知Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,C1O3-可被Fe2+还原为Cl-)
 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:
(2)请分析装置图,进行补充和完善。A部分缺
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是

(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 mol•L-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 mol•L-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为
您最近一年使用:0次
2018-01-18更新
|
314次组卷
|
2卷引用:【全国百强校】吉林省实验中学2019届高三上学期期中考试化学试题



