名校
1 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示。
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示。

已知:① 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
②三颈烧瓶内盛放: 、水和催化剂;
、水和催化剂;
③ ,该反应比较缓慢且
,该反应比较缓慢且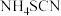 在高于170℃易分解。
在高于170℃易分解。
回答下列问题:
(1)装置A中反应的化学方程式是_______ 。
(2)装置C的作用是_______ 。
(3)制备 溶液:熄灭A处的酒精灯,关闭
溶液:熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,其目的是
,保持三颈烧瓶内液温105℃一段时间,其目的是_______ ,然后打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液。写出装置D中生成
溶液。写出装置D中生成 的化学方程式
的化学方程式_______ 。
(4)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压_______ 、_______ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中 的含量:称取
的含量:称取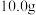 样品,配成
样品,配成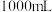 溶液量取
溶液量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。[已知:滴定时发生的反应:
。[已知:滴定时发生的反应: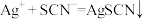 (白色)。]
(白色)。]
①滴定过程的指示剂a为_______ 。
②晶体中 的质量分数为
的质量分数为_______ 。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示。
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示。
已知:①
 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;②三颈烧瓶内盛放:
 、水和催化剂;
、水和催化剂;③
 ,该反应比较缓慢且
,该反应比较缓慢且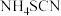 在高于170℃易分解。
在高于170℃易分解。回答下列问题:
(1)装置A中反应的化学方程式是
(2)装置C的作用是
(3)制备
 溶液:熄灭A处的酒精灯,关闭
溶液:熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,其目的是
,保持三颈烧瓶内液温105℃一段时间,其目的是 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液。写出装置D中生成
溶液。写出装置D中生成 的化学方程式
的化学方程式(4)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压
(5)测定晶体中
 的含量:称取
的含量:称取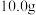 样品,配成
样品,配成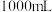 溶液量取
溶液量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。[已知:滴定时发生的反应:
。[已知:滴定时发生的反应: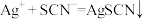 (白色)。]
(白色)。]①滴定过程的指示剂a为
②晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
I.制备N2H4

(1)仪器a的名称是_____ 。
(2)装置C中盛放的试剂是_____ 。装置B的作用是____ 。
(3)制备N2H4的离子方程式为_____ 。
II.测定产品中水合肼(N2H4•H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol•L-1的碘标准溶液滴定(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是_____ 。
②实验测得消耗碘标准溶液的平均值为20.00mL,计算产品中水合腓的质量分数_____ 。
I.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
II.测定产品中水合肼(N2H4•H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol•L-1的碘标准溶液滴定(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00mL,计算产品中水合腓的质量分数
您最近一年使用:0次
2022-10-11更新
|
149次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆中学2022-2023学年高三上学期11月期中化学试题
名校
3 . 某实验小组以BaS浴液为原科制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O的含量。设计了如下实验方案:
可选用试剂:NaCl晶体、BaS溶液、浓H2SO4、稀H2SO4、CuSO4溶液、蒸馏水
步骤1. BaCl2·2H2O的制备
按如图所示装置进行实验,得到BaCl2溶液,经一系列步骤获得BaCl2⋅2H2O产品。

步骤2,产品中BaCl2⋅2H2O的含量测定
①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100mol·L-1H2SO4溶液,
③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.4660g。
回答下列问题:
(1)纯净的试剂a是无色黏稠液体,I是制取_________ (填化学式)气体的装置,在试剂a过量并微热时,发生主要反应的化学方程式为_________ ;
(2)Ⅱ中b仪器的作用是_________ ;III中的试剂应选用_________ ;
(3)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是:静置,向上层清液中继续滴加①_________ 溶液,若②_________ 则已沉淀完全;
(4)沉淀过程中需加入过量的H2SO4溶液,原因是_________ ;
(5)在过滤操作中,下列仪器不需要用到的是_________ (填名称);

(6)产品中BaCl2⋅2H2O的质量分数为_________ (保留三位有效数字)。
可选用试剂:NaCl晶体、BaS溶液、浓H2SO4、稀H2SO4、CuSO4溶液、蒸馏水
步骤1. BaCl2·2H2O的制备
按如图所示装置进行实验,得到BaCl2溶液,经一系列步骤获得BaCl2⋅2H2O产品。

步骤2,产品中BaCl2⋅2H2O的含量测定
①称取产品0.5000g,用100mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的0.100mol·L-1H2SO4溶液,
③沉淀完全后,60℃水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为0.4660g。
回答下列问题:
(1)纯净的试剂a是无色黏稠液体,I是制取
(2)Ⅱ中b仪器的作用是
(3)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是:静置,向上层清液中继续滴加①
(4)沉淀过程中需加入过量的H2SO4溶液,原因是
(5)在过滤操作中,下列仪器不需要用到的是

(6)产品中BaCl2⋅2H2O的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。
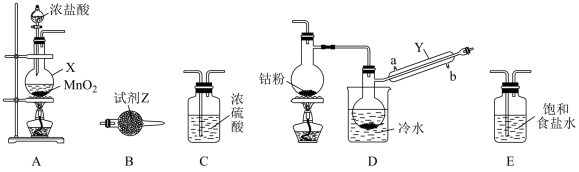
(1)仪器X的名称为____ 。
(2)X中发生反应的离子方程式为____ 。
(3)装置的连接顺序为A→____ →B;反应开始前应先点燃A处的酒精灯,其目的是___ 。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是____ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为____ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为____ ,该样品中钴元素的质量分数为____ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-09-20更新
|
246次组卷
|
2卷引用:黑龙江省绥化市第一中学2022-2023学年高三上学期期中考试化学试题
名校
5 . Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A中用锌和稀盐酸制取氢气。
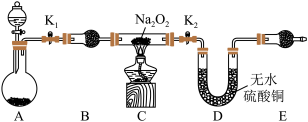
Ⅰ.实验探究
(1)装置B的名称___ ,作用是___ 。
(2)E所盛放的试剂是___ 。
A.浓硫酸B.碱石灰C.无水硫酸铜
(3)下面是实验过程中的重要操作,正确的顺序是___ 。
(4)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为___ 。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C装置内固体中未反应完的Na2O2含量。其操作流程如图:
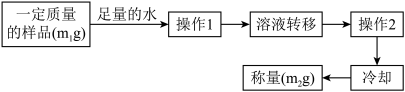
①操作2的名称是___ 。
②固体中Na2O2的质量分数为___ (用含m1和m2的式子表示)。

Ⅰ.实验探究
(1)装置B的名称
(2)E所盛放的试剂是
A.浓硫酸B.碱石灰C.无水硫酸铜
(3)下面是实验过程中的重要操作,正确的顺序是
| A.加热至Na2O2逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
| C.打开K1、K2,通入氢气 | D.停止加热,充分冷却,关闭K1、K2 |
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C装置内固体中未反应完的Na2O2含量。其操作流程如图:

①操作2的名称是
②固体中Na2O2的质量分数为
您最近一年使用:0次
2021-10-11更新
|
840次组卷
|
2卷引用:黑龙江省大庆市肇州县第二中学2021-2022学年高一上学期期中考试化学试题
6 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
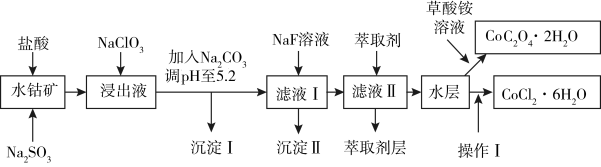
已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中Co2O3发生反应的离子反应方程式为__________ 。
(2)NaClO3在浸出液中的作用________ 。
(3)加入Na2CO3调pH至5.2,目的是______ ;萃取剂层含锰元素,则沉淀II的主要成分为MgF2和____ 。
(4)操作I包括:_________ 、_________ 、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是________ (回答一条原因即可)。

已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为
(2)NaClO3在浸出液中的作用
(3)加入Na2CO3调pH至5.2,目的是
(4)操作I包括:
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是
您最近一年使用:0次
2020-11-04更新
|
422次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2021届高三上学期期中考试化学试题
7 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
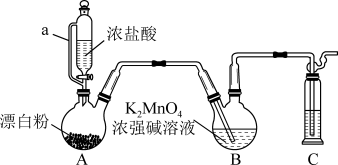
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
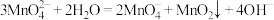
回答下列问题:
(1)装置A中a的作用是______________ ;装置C中的试剂为________________ ;装置A中制备Cl2的化学方程为______________ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________ 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________ (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________ (填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含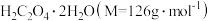 的质量分数表达式为
的质量分数表达式为_________________ 。
下列关于样品组成分析的说法,正确的是__________ (填标号)。
A.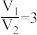 时,样品中一定不含杂质
时,样品中一定不含杂质
B.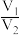 越大,样品中
越大,样品中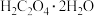 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
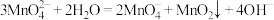
回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含
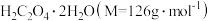 的质量分数表达式为
的质量分数表达式为下列关于样品组成分析的说法,正确的是
A.
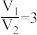 时,样品中一定不含杂质
时,样品中一定不含杂质B.
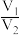 越大,样品中
越大,样品中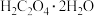 含量一定越高
含量一定越高C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
您最近一年使用:0次
2020-07-11更新
|
9285次组卷
|
27卷引用:黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题
黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题2020年山东省高考化学试卷(新高考)(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编河南省三门峡市第一高级中学2021届高三8月开学考试化学试题江西省高安中学2020-2021学年高二上学期第一次段考化学(A)试题福建省福州市第一中学2021届高三上学期开学质检化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题选择性必修1 专题3素养检测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)山东省济宁市实验中学2022届高三上学期开学考试化学试题山东省临沂市临沭第一中学2022届高三上学期开学考试化学试题(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省潍坊市第一中学2022届高三10月月考化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)北京市第二十中学2022-2023学年高三下学期开学检测化学试题(已下线)第一部分 化学综合实验 热点5 物质制备实验与定量测定实验(已下线)专题19 实验综合题
名校
解题方法
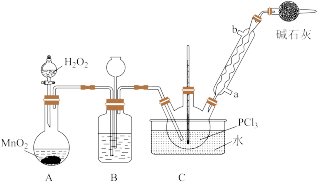
8 . POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____ (填字母代号)。
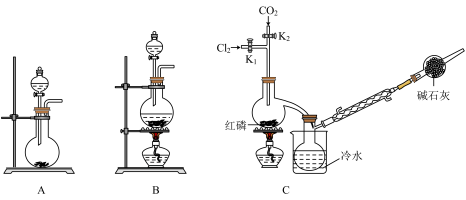
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________ 。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________ 。
(4)反应温度要控制在60~65℃,原因是:_________________________________ 。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol•L﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 mol•L﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________ 。
②产品中Cl元素的质量分数为______________ (保留3位有效数字)。
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的

(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(4)反应温度要控制在60~65℃,原因是:
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol•L﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 mol•L﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是
②产品中Cl元素的质量分数为
您最近一年使用:0次
2019-10-08更新
|
172次组卷
|
3卷引用:黑龙江省牡丹江市绥芬河高级中学2020届高三上学期期中考试化学试题
真题
名校
9 . 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
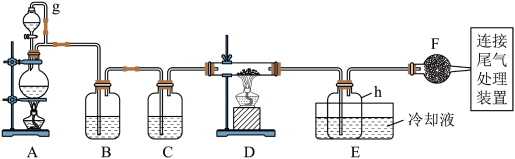
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:____________________________ 。
(2)装置A中g管的作用是______________ ;装置C中的试剂是____________ ;装置E中的h瓶需要冷却的理由是________________________________________ 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________ (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________ (填“是”或“否”),请说明理由:
____________________________________________________________ 。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________ 。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:
(2)装置A中g管的作用是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO
 +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。①滴定前是否要滴加指示剂?
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是
您最近一年使用:0次
2016-12-09更新
|
503次组卷
|
10卷引用:2011-2012学年黑龙江省大庆实验中学高二上学期期中考试化学试卷
(已下线)2011-2012学年黑龙江省大庆实验中学高二上学期期中考试化学试卷2009年普通高等学校招生统一考试理综试题化学部分(浙江卷)09真题汇编-物质的制备、分离与提纯、鉴别与检验2009高考真题分类汇编-碳族元素 无机非金属材料(已下线)2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷2018届高三一轮复习化学:微考点24-硅的制取及应用(已下线)二轮复习 专题6 非金属及其化合物 押题专练(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(押题专练)2020年安徽省全省教学质量检测统一考试(练习检测一)新疆吾尔自治区乌鲁木齐市第七十中学、哈密二中2019-2020学年高二下学期期末考试化学试题
名校
解题方法
10 . 回答下列问题。
Ⅰ.在常温下,某兴趣小组模拟“侯氏制碱法”制取碳酸钠,流程如下:

在常温下,有关物质的溶解度为:
(1)纯碱样品中阳离子的焰色是:___________ 。操作Ⅲ中的实验操作名称为:___________ 。操作Ⅰ和Ⅱ___________ (“能”或“不能”)颠倒。
(2)操作Ⅰ和操作Ⅱ总反应的化学方程式为___________ 。
Ⅱ.制得的纯碱 中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中
中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中 的质量分数。
的质量分数。

(3)确定 溶液是否过量的方法是:向溶液M中滴加
溶液是否过量的方法是:向溶液M中滴加 溶液,如果
溶液,如果___________ (填“有”或“无”)沉淀,则过量。
(4)若沉淀A没有洗涤烘干,导致 的质量分数
的质量分数___________ (填“偏大”、“偏小”或“不变”)。判断沉淀A洗净的方法是:取最后一次洗涤所得滤液,滴加 溶液,若
溶液,若___________ (填“有”或“无”)白色沉淀,则洗涤干净。
(5)样品中 的质量分数为
的质量分数为___________ (用字母m、n的代数式表示)。
Ⅰ.在常温下,某兴趣小组模拟“侯氏制碱法”制取碳酸钠,流程如下:

在常温下,有关物质的溶解度为:
| 物质 |  |  |  |  |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
(1)纯碱样品中阳离子的焰色是:
(2)操作Ⅰ和操作Ⅱ总反应的化学方程式为
Ⅱ.制得的纯碱
 中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中
中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中 的质量分数。
的质量分数。
(3)确定
 溶液是否过量的方法是:向溶液M中滴加
溶液是否过量的方法是:向溶液M中滴加 溶液,如果
溶液,如果(4)若沉淀A没有洗涤烘干,导致
 的质量分数
的质量分数 溶液,若
溶液,若(5)样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-08-16更新
|
277次组卷
|
2卷引用:黑龙江省齐齐哈尔市部分学校2022-2023学年高一上学期11月期中考试化学试题



