名校
1 . 硫氰化钾(KSCN)是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图:

已知:①CS2不溶于水,密度比水大:NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
回答下列问题:
(1)制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。装置B中的试剂是___________ 。D装置中连接分液漏斗和三颈烧瓶的橡皮管的作用是___________ 。
②实验开始时,打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应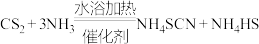 (该反应比较缓慢)至CS2消失。
(该反应比较缓慢)至CS2消失。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后( )。打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
)。打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为___________ 。
②装置E中有浅黄色沉淀出现,写出酸性重铬酸钾(K2Cr2O₇)溶液吸收其中酸性气体的离子方程式为___________ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再___________ 、冷却结晶、___________ 、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品。配成800mL溶液。量取20.00mL。溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用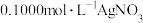 准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应: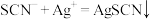 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是___________ 。
②晶体中KSCN的质量分数为___________ 。

已知:①CS2不溶于水,密度比水大:NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
回答下列问题:
(1)制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。装置B中的试剂是
②实验开始时,打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
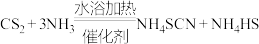 (该反应比较缓慢)至CS2消失。
(该反应比较缓慢)至CS2消失。(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(
 )。打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
)。打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为②装置E中有浅黄色沉淀出现,写出酸性重铬酸钾(K2Cr2O₇)溶液吸收其中酸性气体的离子方程式为
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再
(4)测定晶体中KSCN的含量:称取10.0g样品。配成800mL溶液。量取20.00mL。溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用
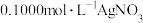 准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。①滴定时发生的反应:
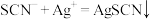 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是②晶体中KSCN的质量分数为
您最近一年使用:0次
2021·全国·模拟预测
名校
解题方法
2 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。回答下列问题:
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液会生成NaClO3;
②利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
③硫酸肼的制备原理为N2H4·H2O+H2SO4=N2H4·H2SO4+H2O。
I.制备NaClO溶液。实验制备装置如图1所示:

(1)图1装置试管内发生主要反应的化学方程式为_______ 。
II.尿素法生产水合肼的装置如图2所示:

(2)把I制得的NaClO溶液注入到图2装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液(物质的量之比1∶2.30),仪器a的名称为_______ ,采用低温(低于20℃)反应,降温的方式可采用_______ ,温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L−1,其反应化学方程式为_______ 。反应结束后,急速升温至108℃开始回流5min,收集108~114℃馏分。
(3)测定馏分中水合肼的含量。称取馏分6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L−1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①判断滴定终点的方法是_______ 。
②实验测得消耗碘标准溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_______ 。
III.硫酸肼的制备
(4)将水合肼转移到烧杯中,滴加一定质量98%的浓硫酸,滴加时间控制在1h左右,温度60℃以下。冷藏沉降2h,得硫酸肼沉淀。抽滤,用无水乙醇洗涤,干燥,得白色硫酸肼固体。用无水乙醇而不用水洗涤的原因是_______ 。
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液会生成NaClO3;
②利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
③硫酸肼的制备原理为N2H4·H2O+H2SO4=N2H4·H2SO4+H2O。
I.制备NaClO溶液。实验制备装置如图1所示:

(1)图1装置试管内发生主要反应的化学方程式为
II.尿素法生产水合肼的装置如图2所示:

(2)把I制得的NaClO溶液注入到图2装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液(物质的量之比1∶2.30),仪器a的名称为
(3)测定馏分中水合肼的含量。称取馏分6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L−1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①判断滴定终点的方法是
②实验测得消耗碘标准溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
III.硫酸肼的制备
(4)将水合肼转移到烧杯中,滴加一定质量98%的浓硫酸,滴加时间控制在1h左右,温度60℃以下。冷藏沉降2h,得硫酸肼沉淀。抽滤,用无水乙醇洗涤,干燥,得白色硫酸肼固体。用无水乙醇而不用水洗涤的原因是
您最近一年使用:0次
2021-05-14更新
|
160次组卷
|
4卷引用:新疆和田地区第二中学2022-2023学年高二上学期11月期中考试化学试题
新疆和田地区第二中学2022-2023学年高二上学期11月期中考试化学试题(已下线)化学-学科网2021年高三5月大联考(新课标Ⅲ卷)云南省腾冲市第八中学2023--2024学年上学期高二第3次月考化学试卷湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
解题方法
3 . 鱼浮灵主要成分为过碳酸钠(2Na2CO3•3H2O2)是水产养殖的速效增氧剂信息:
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。
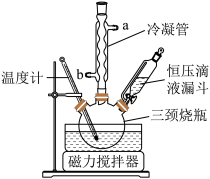
(1)冷凝管中冷凝水的进口是___ (填“a”或“b”),恒压滴液漏斗中盛装的药品是___ 。
(2)实验测定反应温度对产物的影响如表所示,根据表中数据可以得知最佳的反应温度为15—20℃,请说明选择该温度的理由是___ 。
(3)反应结束后,停止搅拌,( ),( ),( ),( ),干燥得到产品,从下列选项中选出合理的操作(操作不能重复使用)并排序___ 。
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
(4)过碳酸钠成分的测定:
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有___ 。
A.干燥产品时采用了加热烘干的方式
B.上述步骤②操作过程中,滴定完成后,俯视滴定管
C.上述步骤③滴定操作前润洗了滴定管和锥形瓶
D.上述步骤③滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
(5)某小组在常温下进行H2O2在不同pH下,相同时间内溶解氧含量测定的实验,数据记录如表:
结合以上数据分析“鱼浮灵”溶于水后在水产养殖中速效增氧的原理是___ 。
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。

(1)冷凝管中冷凝水的进口是
(2)实验测定反应温度对产物的影响如表所示,根据表中数据可以得知最佳的反应温度为15—20℃,请说明选择该温度的理由是
| t/℃ | 活性氧百分含量/% | 产率/% |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
(4)过碳酸钠成分的测定:
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有
A.干燥产品时采用了加热烘干的方式
B.上述步骤②操作过程中,滴定完成后,俯视滴定管
C.上述步骤③滴定操作前润洗了滴定管和锥形瓶
D.上述步骤③滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
(5)某小组在常温下进行H2O2在不同pH下,相同时间内溶解氧含量测定的实验,数据记录如表:
| 试剂 | H2O2 | H2O2+NaCl | H2O2+Na2CO3 | H2O2+NaOH | H2O2+NaOH |
| pH | 6.01 | 5.97 | 8.14 | 8.15 | 9.26 |
| 溶解氧 | 6.44 | 6.48 | 9.11 | 9.12 | 10.97 |
您最近一年使用:0次
2021-04-30更新
|
343次组卷
|
3卷引用:新疆维吾尔自治区疏附县第一中学2021-2022学年高三上学期期中考试化学试题
新疆维吾尔自治区疏附县第一中学2021-2022学年高三上学期期中考试化学试题浙江省平湖市2021届高三4月适应性考试化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
4 . 氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理后的排放情况。
I、实验室通过如图所用的装置制备Na2S2O3

(1)仪器A的名称___ ,使用前注意的事项___ 。
(2)b装置的作用是___ 。
(3)装置a中发生反应的化学方程式____ 。
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为___ (填化学式);反应后剩余的SO2全部被d中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___ (“酸”或“碱”)性,原因是___ 。
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):___ 。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液___ L处理后才可以进行排放。
I、实验室通过如图所用的装置制备Na2S2O3

(1)仪器A的名称
(2)b装置的作用是
(3)装置a中发生反应的化学方程式
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液
您最近一年使用:0次
2019-11-23更新
|
64次组卷
|
2卷引用:新疆维吾尔自治区喀什地区喀什市第六中学2022-2023学年高三上学期10月期中化学试题
2018高三上·全国·专题练习
名校
5 . 硫是一种很活泼的元素,在适宜的条件下能形成−2、+6、+4、+2、+1价的化合物。
Ⅰ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,带有强烈的SO2气味,久置于空气中易被氧化,其溶于水生成的NaHSO3溶液呈酸性。某研究小组采用如图所示装置(实验前已除尽装置内的空气)制取Na2S2O5。

(1)装置Ⅰ中的浓硫酸____ (能或不能)用稀硫酸代替,原因是______________________________________________ 。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的操作是__________ 。
(3)设计检验Na2S2O5晶体在空气中变质的实验方案:_______________ 。
Ⅱ.Na2S2O3溶液可以用于测定溶液中ClO2的含量,实验方案如下。
步骤1:准确量取ClO2溶液10.00 mL,稀释至100 mL。
步骤2:量取V1 mL稀释后的ClO2溶液于锥形瓶中,调节溶液的pH≤2,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I−+H+ I2+Cl−+H2O 未配平)
I2+Cl−+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L−1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32—=2I−+ S4O62—)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是____________ 。
(2)确定滴定终点的现象为________________________________ 。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为____ mol·L−1(用含字母的代数式表示)。
(4)下列操作会导致测定结果偏高的是_______________ (填字母)。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶中有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
Ⅰ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,带有强烈的SO2气味,久置于空气中易被氧化,其溶于水生成的NaHSO3溶液呈酸性。某研究小组采用如图所示装置(实验前已除尽装置内的空气)制取Na2S2O5。

(1)装置Ⅰ中的浓硫酸
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的操作是
(3)设计检验Na2S2O5晶体在空气中变质的实验方案:
Ⅱ.Na2S2O3溶液可以用于测定溶液中ClO2的含量,实验方案如下。
步骤1:准确量取ClO2溶液10.00 mL,稀释至100 mL。
步骤2:量取V1 mL稀释后的ClO2溶液于锥形瓶中,调节溶液的pH≤2,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I−+H+
 I2+Cl−+H2O 未配平)
I2+Cl−+H2O 未配平)步骤3:以淀粉溶液作指示剂,用c mol·L−1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32—=2I−+ S4O62—)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是
(2)确定滴定终点的现象为
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为
(4)下列操作会导致测定结果偏高的是
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶中有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2018-10-15更新
|
461次组卷
|
5卷引用:新疆乌鲁木齐市第八中学2018-2019学年高二上学期期中考试化学试题
新疆乌鲁木齐市第八中学2018-2019学年高二上学期期中考试化学试题四川省成都市航天中学2018-2019学年高二上学期期中考试化学试题(已下线)2018年10月14日 《每日一题》一轮复习-每周一测(已下线)2019年3月3日《每日一题》二轮复习- 每周一测(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测
6 . 氮化镁(Mg3N2)是一种黄绿色粉末,可用于制造特殊陶瓷材料、催化剂等,可由金属镁和纯净的氮气反应制得,某化学兴趣小组同学利用下图所示装置来制备少量的Mg3N2。
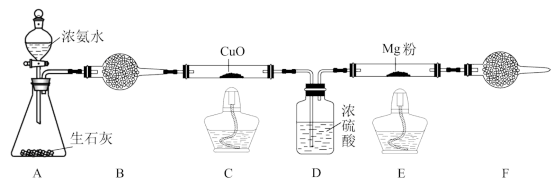
已知Mg3N2易与水反应,有关化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
回答下列问题:
(1)装置A中反应容器的名称为_____________ 。
(2)装置B中的试剂为____________ ,装置F的作用是____________ 。
(3)装置C、E均需要加热,应先加热____________ ,理由是____________ 。
(4)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为____________ 。
(5)若C中NH3的转化率不高,易产生的问题是___________ ,解决办法是___________ 。
(6)若实验结束后,将装置E中固体全部取出,称量为ag,向其中依次加入足量的稀盐酸和NaOH溶液,充分反应后过滤、洗涤、干燥,最后得沉淀bg,则产品中氮化镁的质量分数为__________ 。

已知Mg3N2易与水反应,有关化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
回答下列问题:
(1)装置A中反应容器的名称为
(2)装置B中的试剂为
(3)装置C、E均需要加热,应先加热
(4)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为
(5)若C中NH3的转化率不高,易产生的问题是
(6)若实验结束后,将装置E中固体全部取出,称量为ag,向其中依次加入足量的稀盐酸和NaOH溶液,充分反应后过滤、洗涤、干燥,最后得沉淀bg,则产品中氮化镁的质量分数为
您最近一年使用:0次
2016-12-09更新
|
424次组卷
|
2卷引用:新疆哈密市第八中学2020届高三上学期期中考试化学试题



