名校
解题方法
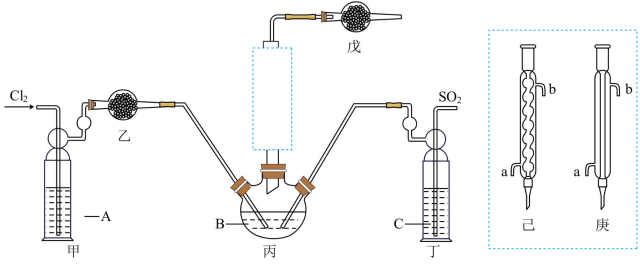
1 . 三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟PCl3+SO2+Cl2→POCl3+SOCl2制备POCl3并测定产品含量。反应装置图如图所示(加热、夹持装置已省略。)
资料卡片:
请回答:
(1)溶液A为饱和食盐水,乙装置中应该盛装的试剂为_______ (填“P2O5”“碱石灰”“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择_______ (填“己”或“庚”)。
(2)甲、丁装置的作用除了用于气体的净化除杂外,还有_______ 。
(3)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_______ 。
(4)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取于10.00mL锥形瓶中,加入的0.2000 mol·L-1 AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000 mol·L-1 KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_______ 。
②POCl3的质量分数为_______ (保留三位有效数字)。
③已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将_______ (填“偏大”“偏小”或“无影响”)。

资料卡片:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
| POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
| SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)溶液A为饱和食盐水,乙装置中应该盛装的试剂为
(2)甲、丁装置的作用除了用于气体的净化除杂外,还有
(3)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是
(4)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取于10.00mL锥形瓶中,加入的0.2000 mol·L-1 AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000 mol·L-1 KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是
②POCl3的质量分数为
③已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将
您最近一年使用:0次
2022-12-17更新
|
387次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期开学考试化学试题
名校
2 . 以 为原料制备氧钒(Ⅳ)碱式碳酸铵
为原料制备氧钒(Ⅳ)碱式碳酸铵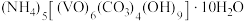 过程如下:
过程如下:
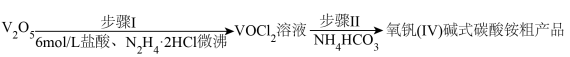
回答下列问题:
(1)步骤Ⅰ的反应装置如图(夹持及加热装置略去,下同)。

①仪器b的名称为_______ ,仪器c的作用为_______ 。
②步骤Ⅰ生成 的同时,生成一种无绝无污染的气体,该反应的化学方程式为
的同时,生成一种无绝无污染的气体,该反应的化学方程式为 _______ 。
(2)步骤Ⅱ可在下图装置中进行。

①接口的连接顺序为
_______ 。
②实验开始时,先关闭 ,打开K1,当
,打开K1,当_______ 时(写实验现象),再关闭K1,打开 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。
③C装置的作用是_______ 。
(3)测定产品纯度。称取 样品用稀硫酸溶解后,加入过量的
样品用稀硫酸溶解后,加入过量的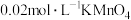 溶液,充分反应后加入过量的
溶液,充分反应后加入过量的 溶液,再加适量尿素除去
溶液,再加适量尿素除去 ,用
,用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为 。(已知:
。(已知: )
)
①样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为 )的质量分数为
)的质量分数为_______ 。
②配制 标准溶液需要用到下列操作:
标准溶液需要用到下列操作:
a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立
b.将塞子反转180°,倒立
c.洗涤烧杯内壁和玻璃棒2~3次
d.冷却至室温
e.轻轻振荡容量瓶
f.称取计算后的试样置于烧杯中,加入适量水充分溶解
g.将溶液转移到容量瓶中
h.定容,摇匀
上述给出操作的正确顺序:a→_______ →h(操作可重复)。
 为原料制备氧钒(Ⅳ)碱式碳酸铵
为原料制备氧钒(Ⅳ)碱式碳酸铵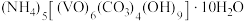 过程如下:
过程如下: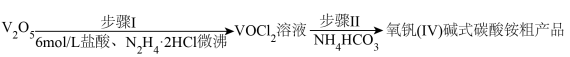
回答下列问题:
(1)步骤Ⅰ的反应装置如图(夹持及加热装置略去,下同)。

①仪器b的名称为
②步骤Ⅰ生成
 的同时,生成一种无绝无污染的气体,该反应的化学方程式为
的同时,生成一种无绝无污染的气体,该反应的化学方程式为 (2)步骤Ⅱ可在下图装置中进行。

①接口的连接顺序为

②实验开始时,先关闭
 ,打开K1,当
,打开K1,当 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。③C装置的作用是
(3)测定产品纯度。称取
 样品用稀硫酸溶解后,加入过量的
样品用稀硫酸溶解后,加入过量的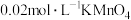 溶液,充分反应后加入过量的
溶液,充分反应后加入过量的 溶液,再加适量尿素除去
溶液,再加适量尿素除去 ,用
,用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为 。(已知:
。(已知: )
)①样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为
 )的质量分数为
)的质量分数为②配制
 标准溶液需要用到下列操作:
标准溶液需要用到下列操作:a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立
b.将塞子反转180°,倒立
c.洗涤烧杯内壁和玻璃棒2~3次
d.冷却至室温
e.轻轻振荡容量瓶
f.称取计算后的试样置于烧杯中,加入适量水充分溶解
g.将溶液转移到容量瓶中
h.定容,摇匀
上述给出操作的正确顺序:a→
您最近一年使用:0次
解题方法
3 . 氯乙烯(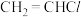 )是一种应用于高分子化工的重要单体,为无色、易液化气体,沸点为
)是一种应用于高分子化工的重要单体,为无色、易液化气体,沸点为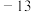 ℃。实验室可利用
℃。实验室可利用 、HCl、
、HCl、 的混合气体在催化剂作用下加热制备氯乙烯。回答下列问题:
的混合气体在催化剂作用下加热制备氯乙烯。回答下列问题:
Ⅰ.HCl的制备
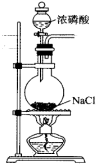
(1)盛装浓磷酸的仪器名称为______ ,已知该反应中参与反应的NaCl与 的物质的量之比为2∶1,写出该反应的化学方程式:
的物质的量之比为2∶1,写出该反应的化学方程式:______ 。
(2)磷酸浓度过低或过高均不利于HCl的逸出,写出磷酸浓度过低不利于HCl逸出的原因:______ 。
Ⅱ.氯乙烯的制备
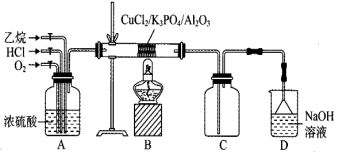
(3)①氯乙烯的电子式为______ 。
②A装置的作用为______ 。
③B中反应的化学方程式为______ 。
(4)该制备过程中会有副反应发生,生成副产物乙烯。 为该反应的催化剂,其中
为该反应的催化剂,其中 为主催化剂,为了提高反应物的转化率和产物氯乙烯的选择性,常需加入助催化剂如KCl、
为主催化剂,为了提高反应物的转化率和产物氯乙烯的选择性,常需加入助催化剂如KCl、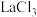 等,图1为K、Cu物质的量之比对催化剂活性的影响,图2为La的百分含量对催化剂活性的影响:
等,图1为K、Cu物质的量之比对催化剂活性的影响,图2为La的百分含量对催化剂活性的影响:

则实际生产过程中应选择的K、Cu的物质的量之比为______ ,La的百分含量为______ 。
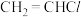 )是一种应用于高分子化工的重要单体,为无色、易液化气体,沸点为
)是一种应用于高分子化工的重要单体,为无色、易液化气体,沸点为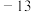 ℃。实验室可利用
℃。实验室可利用 、HCl、
、HCl、 的混合气体在催化剂作用下加热制备氯乙烯。回答下列问题:
的混合气体在催化剂作用下加热制备氯乙烯。回答下列问题:Ⅰ.HCl的制备

(1)盛装浓磷酸的仪器名称为
 的物质的量之比为2∶1,写出该反应的化学方程式:
的物质的量之比为2∶1,写出该反应的化学方程式:(2)磷酸浓度过低或过高均不利于HCl的逸出,写出磷酸浓度过低不利于HCl逸出的原因:
Ⅱ.氯乙烯的制备

(3)①氯乙烯的电子式为
②A装置的作用为
③B中反应的化学方程式为
(4)该制备过程中会有副反应发生,生成副产物乙烯。
 为该反应的催化剂,其中
为该反应的催化剂,其中 为主催化剂,为了提高反应物的转化率和产物氯乙烯的选择性,常需加入助催化剂如KCl、
为主催化剂,为了提高反应物的转化率和产物氯乙烯的选择性,常需加入助催化剂如KCl、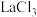 等,图1为K、Cu物质的量之比对催化剂活性的影响,图2为La的百分含量对催化剂活性的影响:
等,图1为K、Cu物质的量之比对催化剂活性的影响,图2为La的百分含量对催化剂活性的影响:
则实际生产过程中应选择的K、Cu的物质的量之比为
您最近一年使用:0次
名校
4 . 二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
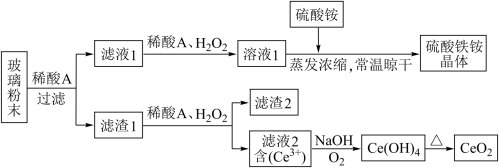
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________ 。
(2)滤液1中加入H2O2溶液的目的是____________________ 。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________ 。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________ 。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________ 。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________ 。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________ (结果保留两位有效数字)。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是
(2)滤液1中加入H2O2溶液的目的是
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式
(5)由滤液2生成Ce(OH)4的离子方程式
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为
您最近一年使用:0次



