名校
1 . 亚磷酸(H3PO3)与足量的NaOH溶液反应生成 Na2HPO3。
(1)亚磷酸中P的化合价为________ 价, 是_________ 元酸。
(2)在H3PO3溶液中存在电离平衡: H3PO3 H++H2PO3-。
H++H2PO3-。
①某温度下,0.10mol·L-1的H3PO3溶液 pH =1.6,即溶液中 c(H+) =2.5×10-2 mol·L-1。 则该温度下,上述电离平衡的平衡常数 K=________________ (只考虑H3PO3的第一步电离,结果保留两位有效数字)。
②根据H3PO3的性质可推测Na2HPO3稀溶液的 pH____ 7 (填“ >”、“=”或“ <”)。
(3)亚磷酸具有强还原性,可将 Cu2+还原为金属单质,H3PO3与CuSO4溶液反应的化学方程式为___________________________________________ 。
(4)电解 Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

①阴极的电极反应式为___________________________________ ;
②产品室中反应的离子方程式为___________________________ 。
(5)在热水中, PCl5 能完全水解,生成磷酸(H3PO4),若将 0.01molPCl5 投入1L热水中,再逐滴加入AgNO3 溶液,先产生的沉淀是____ (填化学式)。 [已知Ksp(Ag3PO4)=1.4×10-16, Ksp(AgCl)=1.8×10-10]
(1)亚磷酸中P的化合价为
(2)在H3PO3溶液中存在电离平衡: H3PO3
 H++H2PO3-。
H++H2PO3-。①某温度下,0.10mol·L-1的H3PO3溶液 pH =1.6,即溶液中 c(H+) =2.5×10-2 mol·L-1。 则该温度下,上述电离平衡的平衡常数 K=
②根据H3PO3的性质可推测Na2HPO3稀溶液的 pH
(3)亚磷酸具有强还原性,可将 Cu2+还原为金属单质,H3PO3与CuSO4溶液反应的化学方程式为
(4)电解 Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

①阴极的电极反应式为
②产品室中反应的离子方程式为
(5)在热水中, PCl5 能完全水解,生成磷酸(H3PO4),若将 0.01molPCl5 投入1L热水中,再逐滴加入AgNO3 溶液,先产生的沉淀是
您最近一年使用:0次
名校
2 . 以硅孔雀石(主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3•Cu(OH)2反应的化学方程式为____ 。为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当加快搅拌速率;②______________ 。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________ 。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______________ (填化学式);试剂X可选择_____ (填字母)。
a. Cu b. NaOH c. Cu(OH)2d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________ 。
(5)“加热脱水”时,加入SOCl2的目的是_________________________ 。

已知:SOCl2+H2O
 SO2↑+2HCl↑
SO2↑+2HCl↑(1)“酸浸”时盐酸与CuCO3•Cu(OH)2反应的化学方程式为
(2)“氧化”时发生反应的离子方程式为
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为
a. Cu b. NaOH c. Cu(OH)2d.氨水
(4)“调pH”时,pH不能过高,其原因是
(5)“加热脱水”时,加入SOCl2的目的是
您最近一年使用:0次
2016高二·全国·课时练习
3 . 1乙氧基萘是一种无色液体,密度比水的大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇。乙醇的沸点为78.5℃。1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的反应原理如下:
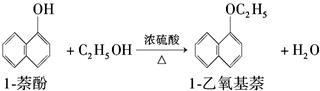
(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是________ 。烧瓶上连接长玻璃管的主要作用是________________ 。
(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________ (填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是__________ 、____________ 。

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。

(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是

(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是
A.③②④① B.①②③④ C.②①③④
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是

(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
| 实验目的 | 实验操作 | 预期现象和结论 |
| ①用金属钠检验1乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若 若 |
| ②检验经提纯的产品是否含有1萘酚 | 若 若 |
您最近一年使用:0次
4 . 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

请回答下列问题:
(1)写出反应①的化学方程式:__________________ 。
(2)滤液Ⅰ中加入CaO生成的沉淀是_______ (填化学式),反应②的离子方程式为______________ 。
(3)写出由气体D制备冰晶石的化学方程式:__________________ 。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

请回答下列问题:
(1)写出反应①的化学方程式:
(2)滤液Ⅰ中加入CaO生成的沉淀是
(3)写出由气体D制备冰晶石的化学方程式:
您最近一年使用:0次
名校
5 . 利用下图装置制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是—种高效氧化剂、漂白剂)。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。

完成下列填空:
(1)装置②中产生ClO2的化学方程式为________ 。装置④中发生反应的离子方程式为_______ 。
(2)装置③的作用是_____________________ 。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②___ ;③___ ;④低于60℃干燥,得到成品。
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因______________________ 。
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1Na2S2O3完全反应(I2+2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为___ 。

完成下列填空:
(1)装置②中产生ClO2的化学方程式为
(2)装置③的作用是
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1Na2S2O3完全反应(I2+2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为
您最近一年使用:0次
6 . 铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________ 。
(2)弯曲的a管所起的作用是_____________ ;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是____________________ 。
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为________ %。
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是___________________ 。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是______________________ 。
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为
(2)弯曲的a管所起的作用是
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是
您最近一年使用:0次
2017-11-05更新
|
206次组卷
|
2卷引用:陕西省黄陵中学2017-2018学年高二(重点班)6月月考化学试题
名校
7 . 二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g) SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
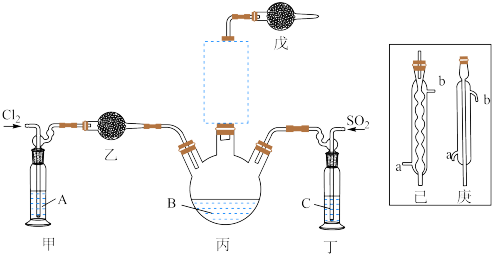
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为_________ ;溶液A为____ 。
②上图实框中仪器己的名称为_____ ;反应装置图的虚框中未画出的仪器是____ (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是___________ 。
④下列有关说法错误的是________ (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是____________________ 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为_________ %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是______ 。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)
 SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为
②上图实框中仪器己的名称为
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是
④下列有关说法错误的是
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是
您最近一年使用:0次
2016-12-09更新
|
223次组卷
|
3卷引用:湖南省衡阳市第八中学2016-2017学年高二理科实验班下学期第二次月考理科综合化学试题
名校
8 . 食盐加碘剂的主要成分是碘酸钾(KIO3)。工业上可用碘为原料通过电解制备碘酸钾。
【实验一】在已经提取氯化钠、溴、镁等化学物质后的富碘卤水中,采用下面的工艺流程生产单质碘:

(1)写出步骤②的离子方程式_______ 。
(2)上述生产流程中,可以利用的副产物是_______ 。
(3)分离I2和丁的方法是_______ 。
【实验二】电解制取KIO3,电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。

(4)电解时,阳极上发生反应的电极反应式为_______ ;电解过程中阴极附近溶液pH_______ (填“变大”、“变小”或“不变”)。
【实验三】电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

(5)步骤②的操作名称_______ ,步骤④洗涤晶体的目的是_______ 。
【实验一】在已经提取氯化钠、溴、镁等化学物质后的富碘卤水中,采用下面的工艺流程生产单质碘:

(1)写出步骤②的离子方程式
(2)上述生产流程中,可以利用的副产物是
(3)分离I2和丁的方法是
【实验二】电解制取KIO3,电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。

(4)电解时,阳极上发生反应的电极反应式为
【实验三】电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

(5)步骤②的操作名称
您最近一年使用:0次
2016-12-09更新
|
309次组卷
|
2卷引用:河南省周口恒大中学2022-2023学年高二下学期4月期中考试化学试题
9 . 对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是________________________ 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于______ 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________ 。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________ 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是___________________ 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有____________ 。
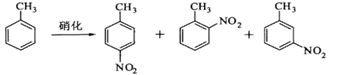
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是
(2)滤液在分液漏斗中洗涤静置后,有机层处于
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂) n(甲苯) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有
您最近一年使用:0次
2016-12-09更新
|
233次组卷
|
3卷引用:14-15辽宁省实验分校高二上学期期末化学(理)试卷
12-13高二上·甘肃白银·期末
解题方法
10 . 普通玻璃的主要原料是纯碱、石灰石和石英,窑里加强热时,纯碱与石英的 反应化学方程式为Na2CO3+SiO2 Na2SiO3+CO2↑,其中产物Na2SiO3 的名称为
Na2SiO3+CO2↑,其中产物Na2SiO3 的名称为_______ ,仿造这个方程式,写出石灰石(CaCO3)与SiO2 加强热的反应方程式_______ .
 Na2SiO3+CO2↑,其中产物Na2SiO3 的名称为
Na2SiO3+CO2↑,其中产物Na2SiO3 的名称为
您最近一年使用:0次
2016-12-09更新
|
649次组卷
|
3卷引用:2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(文)试卷
(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(文)试卷陕西省岐山县2017-2018学年高二上学期期末质量检测(文科)化学试题2017-2018学年人教新版高一化学必修一第四章第一节基础题



