1 . 有机化合物A常用于配制香水、精油,为测定A的结构,某化学兴趣小组进行如下实验。回答下列问题:
(1)13.6g有机物A置于氧气流中充分燃烧,生成17.92L (标准状况)和7.2g
(标准状况)和7.2g ,通过质谱仪测得A的相对分子质量为136,则A的分子式为
,通过质谱仪测得A的相对分子质量为136,则A的分子式为_______ 。有机物A的红外光谱如图所示,则A可能的结构简式为_______ 、_______ 。
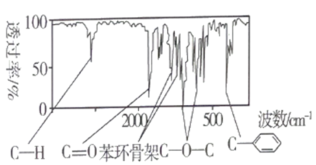
(2)请设计简单实验,确定A的结构简式_______ 。(可选用的试剂:银氨溶液,氢氧化钠溶液,稀硫酸,限选一种试剂)
(3)探究制备A的最佳反应条件:
①该小组成员通过核磁共振仪测定A的核磁共振氢谱如图所示。在实验室中,利用有机酸B和醇C,通过酯化反应制备A的化学方程式为_______ 。反应结束后,可用_______ (填序号)洗涤粗产品A。
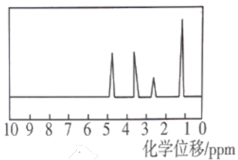
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇 D.水
②该小组通过监测混合物中有机酸B的含量,探究制备A的最佳反应温度。已知:A、B、C的熔沸点如表-1所示,有机酸B的含量如图3。该反应的最佳温度为_______ (填序号)。温度超过106℃后,B的含量逐渐增大的原因为_______ 。
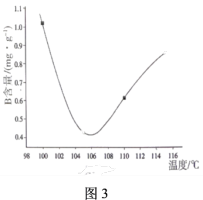
A.100℃ B.106℃ C.116℃
(1)13.6g有机物A置于氧气流中充分燃烧,生成17.92L
 (标准状况)和7.2g
(标准状况)和7.2g ,通过质谱仪测得A的相对分子质量为136,则A的分子式为
,通过质谱仪测得A的相对分子质量为136,则A的分子式为
(2)请设计简单实验,确定A的结构简式
(3)探究制备A的最佳反应条件:
①该小组成员通过核磁共振仪测定A的核磁共振氢谱如图所示。在实验室中,利用有机酸B和醇C,通过酯化反应制备A的化学方程式为

A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇 D.水
②该小组通过监测混合物中有机酸B的含量,探究制备A的最佳反应温度。已知:A、B、C的熔沸点如表-1所示,有机酸B的含量如图3。该反应的最佳温度为
| 物质 | 熔点 | 沸点 |
| A | -12.3 | 199.6 |
| B | 122.4 | 249 |
| C | - 97 | 64.3 |

A.100℃ B.106℃ C.116℃
您最近一年使用:0次
2 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸溶液是常用的消毒剂,可利用Cl2O与水反应得到。根据该原理,某化学兴趣小组利用如下装置制备一定浓度的次氯酸溶液。已知:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解为Cl2和O2。实验时,将氯气和空气(不参与反应)按体积比为1:3混合通入含水8%的碳酸钠糊状物中,请回答下列问题:
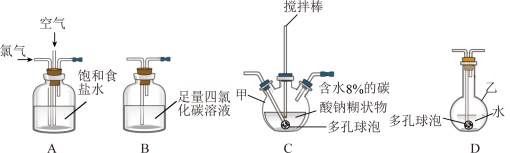
(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为_______ 。
(2)装置C中的仪器甲的名称为_______ ,仪器甲中发生反应的化学方程式为_______ ,为了提高 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为_______ 。
(3)装置 的作用为
的作用为_______ ,有同学建议将装置 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是_______ 。
(4)测定装置D中得到的次氯酸的物质的量浓度。量取 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为_______ 。
②达到滴定终点的现象为_______ 。
③装置D中得到的次氯酸的物质的量浓度为_______ mol/L。
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将_______ (填“偏低”、“偏高”或“无影响”)。

(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为
(2)装置C中的仪器甲的名称为
 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为(3)装置
 的作用为
的作用为 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是(4)测定装置D中得到的次氯酸的物质的量浓度。量取
 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为
②达到滴定终点的现象为
③装置D中得到的次氯酸的物质的量浓度为
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将
您最近一年使用:0次
3 . 以工厂烟气中的 为原料制备脱氯剂
为原料制备脱氯剂 。
。
(1) 制备。边搅拌边向
制备。边搅拌边向 溶液中通入
溶液中通入 。
。
① 溶液中通入
溶液中通入 得到
得到 ,其离子方程式为
,其离子方程式为_______ 。
② 溶液中
溶液中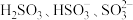 随
随 的分布下图所示。确定何时停止通
的分布下图所示。确定何时停止通 的操作为
的操作为_______ 。

(2) 制备。请补充完整由S和
制备。请补充完整由S和 溶液制备
溶液制备 的实验方案:向过量硫磺粉中加入
的实验方案:向过量硫磺粉中加入 溶液,加热充分反应,
溶液,加热充分反应,_______ ,低温干燥得产品。[实验中必须使用的试剂:无水乙醇]
(3)废水中 的测定。取出一定量废水于锥形瓶中,加入足量硫酸酸化的
的测定。取出一定量废水于锥形瓶中,加入足量硫酸酸化的 溶液,充分反应后加入2~3滴淀粉溶液,然后用
溶液,充分反应后加入2~3滴淀粉溶液,然后用 标准溶液滴定。已知:
标准溶液滴定。已知: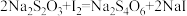 。
。

①滴定达到终点时的实验现象是_______ 。
②若滴定过程中滴定管中的液面如图所示,则a=_______  。
。
 为原料制备脱氯剂
为原料制备脱氯剂 。
。(1)
 制备。边搅拌边向
制备。边搅拌边向 溶液中通入
溶液中通入 。
。①
 溶液中通入
溶液中通入 得到
得到 ,其离子方程式为
,其离子方程式为②
 溶液中
溶液中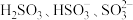 随
随 的分布下图所示。确定何时停止通
的分布下图所示。确定何时停止通 的操作为
的操作为
(2)
 制备。请补充完整由S和
制备。请补充完整由S和 溶液制备
溶液制备 的实验方案:向过量硫磺粉中加入
的实验方案:向过量硫磺粉中加入 溶液,加热充分反应,
溶液,加热充分反应,(3)废水中
 的测定。取出一定量废水于锥形瓶中,加入足量硫酸酸化的
的测定。取出一定量废水于锥形瓶中,加入足量硫酸酸化的 溶液,充分反应后加入2~3滴淀粉溶液,然后用
溶液,充分反应后加入2~3滴淀粉溶液,然后用 标准溶液滴定。已知:
标准溶液滴定。已知: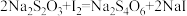 。
。
①滴定达到终点时的实验现象是
②若滴定过程中滴定管中的液面如图所示,则a=
 。
。
您最近一年使用:0次
解题方法
4 . 二氧化氯(ClO2)是一种高效的灭菌消毒剂,受热或浓度过大时易发生分解甚至爆炸。工业上常将ClO2制备成NaClO2固体以便运输和贮存,流程如下:
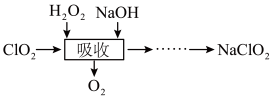
(1)“吸收”过程中发生反应的离子方程式是_______ 。
(2)“吸收”过程,温度控制在25℃的目的是_______ (填字母)。
a.保持适当的反应速率 b.促进H2O2分解 c.防止温度过高引起爆炸
(3)NaClO2的溶解度曲线如图所示,由NaClO2溶液得到无水NaClO2的操作如下:

①减压,55℃蒸发结晶;
②_______ ;
③38℃~60℃热水洗涤;
④低于60℃干燥。

(1)“吸收”过程中发生反应的离子方程式是
(2)“吸收”过程,温度控制在25℃的目的是
a.保持适当的反应速率 b.促进H2O2分解 c.防止温度过高引起爆炸
(3)NaClO2的溶解度曲线如图所示,由NaClO2溶液得到无水NaClO2的操作如下:

①减压,55℃蒸发结晶;
②
③38℃~60℃热水洗涤;
④低于60℃干燥。
您最近一年使用:0次
5 . 高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2•6H2O]的一种工艺流程如图1所示:

(1)发生“电解Ⅰ”时,所用的交换膜是____ (填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为____ 。
②“电解Ⅱ”的阳极产物为____ 。
(3)操作a的名称是____ ,该流程中可循环利用的物质是____ (填化学式)。
(4)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为ag,最终制得的Cu(ClO4)2•6H2O为bg,则产率为____ (用含a、b的代数式表示)。
(5)某温度下,高氯酸铜按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。A方式为Cu(ClO4)2 CuCl2+4O2↑,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为
CuCl2+4O2↑,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为____ (用化学方程式表示)。

(1)发生“电解Ⅰ”时,所用的交换膜是
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为
②“电解Ⅱ”的阳极产物为
(3)操作a的名称是
(4)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为ag,最终制得的Cu(ClO4)2•6H2O为bg,则产率为
(5)某温度下,高氯酸铜按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。A方式为Cu(ClO4)2
 CuCl2+4O2↑,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为
CuCl2+4O2↑,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为
您最近一年使用:0次
6 . 脱硝技术主要用于脱除燃煤烟气中的NO。
I.配合物生物脱硝法
以Fe(II)EDTA2-为吸收剂结合微生物进行脱硝的原理如图所示:

已知:NO 、NO
、NO 会使微生物总量下降。
会使微生物总量下降。
(1)若烟气中参与反应的n(NO):n(O2)=1:1,碳源为C6H12O6,写出过程中脱硝总反应的化学方程式_______ 。
(2)该原理中将“化学吸收”与“生物还原”分开在不同容器中进行的原因是_______ 。
Ⅱ.ClO2氧化脱硝法
电解NaClO3制备ClO2的装置如图所示。

(3)写出该电解过程中总反应的化学方程式_______ 。
(4)ClO2氧化脱硝过程发生的反应是:5NO+3ClO2+4H2O=5HNO3+3HCl。已知:①ClO2与水能产生•OH,•OH更易与NO反应;②ClO2受热易分解,反应为2ClO2=Cl2+2O2。当烟气流速、烟气中NO浓度及n(ClO2)/n(NO)一定时,温度对NO脱除效率的影响如图所示。温度升高,脱硝率变化不大的原因可能是_______ 。

(5)烟气中混有的SO2能与ClO2反应。
①写出SO2与溶液中ClO2反应的离子方程式_______ 。
②其他条件一定时,SO2浓度的增加对脱硝率影响不大,其原因可能是_______ 。
I.配合物生物脱硝法
以Fe(II)EDTA2-为吸收剂结合微生物进行脱硝的原理如图所示:

已知:NO
 、NO
、NO 会使微生物总量下降。
会使微生物总量下降。(1)若烟气中参与反应的n(NO):n(O2)=1:1,碳源为C6H12O6,写出过程中脱硝总反应的化学方程式
(2)该原理中将“化学吸收”与“生物还原”分开在不同容器中进行的原因是
Ⅱ.ClO2氧化脱硝法
电解NaClO3制备ClO2的装置如图所示。

(3)写出该电解过程中总反应的化学方程式
(4)ClO2氧化脱硝过程发生的反应是:5NO+3ClO2+4H2O=5HNO3+3HCl。已知:①ClO2与水能产生•OH,•OH更易与NO反应;②ClO2受热易分解,反应为2ClO2=Cl2+2O2。当烟气流速、烟气中NO浓度及n(ClO2)/n(NO)一定时,温度对NO脱除效率的影响如图所示。温度升高,脱硝率变化不大的原因可能是

(5)烟气中混有的SO2能与ClO2反应。
①写出SO2与溶液中ClO2反应的离子方程式
②其他条件一定时,SO2浓度的增加对脱硝率影响不大,其原因可能是
您最近一年使用:0次
解题方法
7 . 硫酸是最重要的化工产品之一,常用于物质的制备、催化等领域。
(1)工业上用硫酸制备硫酸铜。
方案I:将铜与浓硫酸共热,反应生成硫酸铜。
方案II:向铜与稀硫酸的混合物中持续通入氧气并加热,反应原理: 。
。
①方案I反应的化学方程式为___________ 。
②在实验室中,将浓硫酸稀释为稀硫酸的操作方法为___________ 。
③比较以上两种制备方案,哪一种方案更好,理由是___________ 。
(2)浓硫酸常用作实验室制取乙酸乙酯的催化剂。制取乙酸乙酯的化学方程式为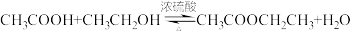 ,乙酸中所含官能团的名称为
,乙酸中所含官能团的名称为_______ 。
(1)工业上用硫酸制备硫酸铜。
方案I:将铜与浓硫酸共热,反应生成硫酸铜。
方案II:向铜与稀硫酸的混合物中持续通入氧气并加热,反应原理:
 。
。①方案I反应的化学方程式为
②在实验室中,将浓硫酸稀释为稀硫酸的操作方法为
③比较以上两种制备方案,哪一种方案更好,理由是
(2)浓硫酸常用作实验室制取乙酸乙酯的催化剂。制取乙酸乙酯的化学方程式为
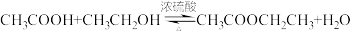 ,乙酸中所含官能团的名称为
,乙酸中所含官能团的名称为
您最近一年使用:0次
名校
8 . I.实验室以K2MnO4为原料,用两种方法制备高锰酸钾。已知:K2MnO4在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。
(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知_______ 。
②停止通入CO2,过滤除去_______ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到KMnO4粗品。若CO2通入过多,产品中可能混有的杂质是_______ 。
(2)电解法:实验装置如图。

①阳极的电极反应式为_______ ,阴极产生的气体为_______ (填化学式)。
②与CO2法相比,电解法的主要优点是_______ (写一条)。,
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为_______ 。
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为_______ 。
 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入CO2,过滤除去
(2)电解法:实验装置如图。

①阳极的电极反应式为
②与CO2法相比,电解法的主要优点是
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为
您最近一年使用:0次
9 . 回答下列问题
I.雄黄( )和雌黄(
)和雌黄( )是提取砷的主要矿物原料,二者在自然界中共生。
)是提取砷的主要矿物原料,二者在自然界中共生。
(1) 和SnCl2在盐酸中反应转化为
和SnCl2在盐酸中反应转化为 和
和 并放出
并放出 气体。若
气体。若 和
和 恰好完全反应,则参加反应的
恰好完全反应,则参加反应的 和HCl的物质的量之比为
和HCl的物质的量之比为___________ ,写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目:___________ 。
(2)上述反应中的氧化剂是___________ (填化学式),反应产生的气体可用___________ 吸收。
Ⅱ.实验室中以粗铜粉(含杂质Fe)为原料,制备铜的氯化物的流程如图所示:

(3)现用如图所示的实验仪器和药品制备纯净、干燥的 并与粗铜粉反应(夹持及加热装置已省略)。
并与粗铜粉反应(夹持及加热装置已省略)。
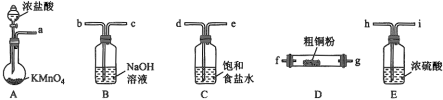
①按气流从左到右的方向连接各仪器接口,正确的顺序是a→___________ (填仪器接口小写字母)。实验中,加热硬质玻璃管前要进行一步重要操作,该操作是___________ 。
②操作②的方法是___________ 。
(4)向溶液Ⅱ中通入一定量的 ,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:
,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:___________ 。
I.雄黄(
 )和雌黄(
)和雌黄( )是提取砷的主要矿物原料,二者在自然界中共生。
)是提取砷的主要矿物原料,二者在自然界中共生。(1)
 和SnCl2在盐酸中反应转化为
和SnCl2在盐酸中反应转化为 和
和 并放出
并放出 气体。若
气体。若 和
和 恰好完全反应,则参加反应的
恰好完全反应,则参加反应的 和HCl的物质的量之比为
和HCl的物质的量之比为(2)上述反应中的氧化剂是
Ⅱ.实验室中以粗铜粉(含杂质Fe)为原料,制备铜的氯化物的流程如图所示:

(3)现用如图所示的实验仪器和药品制备纯净、干燥的
 并与粗铜粉反应(夹持及加热装置已省略)。
并与粗铜粉反应(夹持及加热装置已省略)。
①按气流从左到右的方向连接各仪器接口,正确的顺序是a→
②操作②的方法是
(4)向溶液Ⅱ中通入一定量的
 ,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:
,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:
您最近一年使用:0次
20-21高二下·浙江·阶段练习
解题方法
10 . I.电镀废水中常含有阴离子A,排放前可加CuSO4溶液处理,使之转化为沉淀B,按如图流程进行实验。
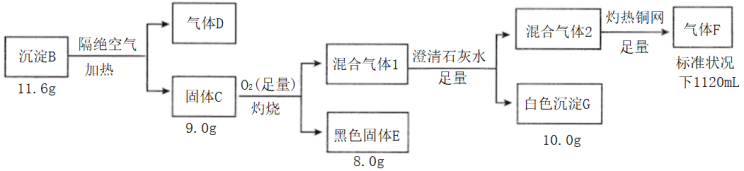
已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是___ 气体,D的分子式是___ 。
(2)写出C足量氧气中灼烧的方程式是___ 。
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是___ 。
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。
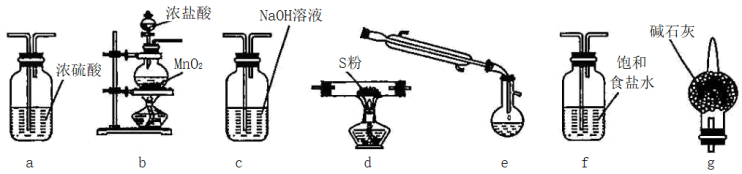
请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2___ 。
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___ 。

已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是
(2)写出C足量氧气中灼烧的方程式是
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式
您最近一年使用:0次



