名校
解题方法
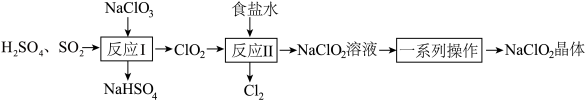
1 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO2•3H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
(1)NaClO2中氯元素的化合价为___________ 。
(2)“反应I”中氧化剂与还原剂的物质的量之比为___________ 。
(3)“反应Ⅱ”的离子方程式为___________ 。
(4)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和 ,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
(5)“一系列操作”为蒸发浓缩、趁热过滤、___________ 、干燥,其中“趁热过滤”应控制的温度范围是___________ 。
(6)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与 的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为___________ 。
(1)NaClO2中氯元素的化合价为
(2)“反应I”中氧化剂与还原剂的物质的量之比为
(3)“反应Ⅱ”的离子方程式为
(4)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和
 ,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)| A.①②③④ | B.②①③④ | C.③①②④ | D.③②①④ |
(5)“一系列操作”为蒸发浓缩、趁热过滤、
(6)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与
 的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
您最近一年使用:0次
2024-02-11更新
|
609次组卷
|
5卷引用:湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷
湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷2024届河南省南阳市方城县第一高级中学高一上学期1月期末模拟预测化学试题安徽省六安市叶集皖西当代中学2023-2024学年高一下学期3月月考化学试题(已下线)通关练04 化工微流程-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省长沙市第一中学2023-2024学年高一下学期第一次阶段性检测(月考)化学试题
名校
2 . 二氯六氨合铜 是一种重要的化工产品。某小组拟制备
是一种重要的化工产品。某小组拟制备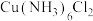 并测定其纯度。制备原理是强冷条件下:
并测定其纯度。制备原理是强冷条件下: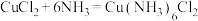 。
。
(一)制备产品,实验装置如图所示。
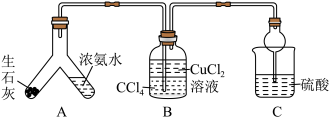
(1)装置B中添加四氯化碳的目的是_______ 。
(2)启动装置A中反应的操作是_______ ;用平衡移动原理解释制备氨气的原理:_______ 。
(3)实验完毕后,向装置B中加入适量乙醇,析出蓝色晶体,经过_______ 、洗涤、晾干得到产品。
(二)测定产品纯度,实验装置如图所示。
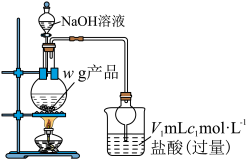
向烧瓶中加入足量 溶液,产生蓝色沉淀,逸出的氨气被过量的盐酸吸收;完全反应后,取下烧杯并用蒸馏水冲洗干燥管,将洗涤液和烧杯中的溶液合并。稀释溶液至
溶液,产生蓝色沉淀,逸出的氨气被过量的盐酸吸收;完全反应后,取下烧杯并用蒸馏水冲洗干燥管,将洗涤液和烧杯中的溶液合并。稀释溶液至 ,准确量取该溶液
,准确量取该溶液 于锥形瓶中,滴几滴指示剂
于锥形瓶中,滴几滴指示剂 ,用
,用 标准溶液滴定至终点,消耗滴定液
标准溶液滴定至终点,消耗滴定液 (假设杂质不参与反应)。
(假设杂质不参与反应)。
(4)指示剂X应选择_______ 。
(5)该产品的纯度为_______ (用含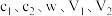 的代数式表示)。如果碱式滴定管没有润洗,测得的结果
的代数式表示)。如果碱式滴定管没有润洗,测得的结果_______ (填“偏高”“偏低”或“无影响”)。
 是一种重要的化工产品。某小组拟制备
是一种重要的化工产品。某小组拟制备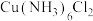 并测定其纯度。制备原理是强冷条件下:
并测定其纯度。制备原理是强冷条件下: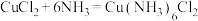 。
。(一)制备产品,实验装置如图所示。

(1)装置B中添加四氯化碳的目的是
(2)启动装置A中反应的操作是
(3)实验完毕后,向装置B中加入适量乙醇,析出蓝色晶体,经过
(二)测定产品纯度,实验装置如图所示。

向烧瓶中加入足量
 溶液,产生蓝色沉淀,逸出的氨气被过量的盐酸吸收;完全反应后,取下烧杯并用蒸馏水冲洗干燥管,将洗涤液和烧杯中的溶液合并。稀释溶液至
溶液,产生蓝色沉淀,逸出的氨气被过量的盐酸吸收;完全反应后,取下烧杯并用蒸馏水冲洗干燥管,将洗涤液和烧杯中的溶液合并。稀释溶液至 ,准确量取该溶液
,准确量取该溶液 于锥形瓶中,滴几滴指示剂
于锥形瓶中,滴几滴指示剂 ,用
,用 标准溶液滴定至终点,消耗滴定液
标准溶液滴定至终点,消耗滴定液 (假设杂质不参与反应)。
(假设杂质不参与反应)。(4)指示剂X应选择
(5)该产品的纯度为
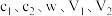 的代数式表示)。如果碱式滴定管没有润洗,测得的结果
的代数式表示)。如果碱式滴定管没有润洗,测得的结果
您最近一年使用:0次
2024-02-08更新
|
140次组卷
|
3卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
名校
解题方法
3 .  是一种优质还原剂,是运载火箭的固体燃料。某实验小组采用“循环利用氯化锂法”制备
是一种优质还原剂,是运载火箭的固体燃料。某实验小组采用“循环利用氯化锂法”制备 ,实验步骤如下:
,实验步骤如下:
①制备 :氯化锂、钠、氢气在500~600℃下反应得到混合物;
:氯化锂、钠、氢气在500~600℃下反应得到混合物;
②制备 :将
:将 溶于乙醚后与无水氯化铝反应。
溶于乙醚后与无水氯化铝反应。
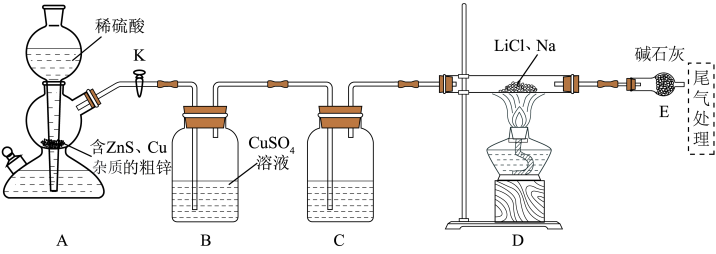
制备 的实验装置如下:
的实验装置如下:
回答下列问题:
(1)实验开始,检验装置气密性,添加药品完毕,加热 装置前应进行的操作是
装置前应进行的操作是___________ 。
(2)B装置中发生反应的离子方程式为___________ ,E装置的作用是___________ 。
(3)制备 的化学方程式为
的化学方程式为___________ 。
(4)乙醚作溶剂的优点是___________ 。
(5)采用该方法制备 的突出优点是
的突出优点是___________ 。
(6) 的还原能力比
的还原能力比 更强大,原因是
更强大,原因是___________ 。
 是一种优质还原剂,是运载火箭的固体燃料。某实验小组采用“循环利用氯化锂法”制备
是一种优质还原剂,是运载火箭的固体燃料。某实验小组采用“循环利用氯化锂法”制备 ,实验步骤如下:
,实验步骤如下:①制备
 :氯化锂、钠、氢气在500~600℃下反应得到混合物;
:氯化锂、钠、氢气在500~600℃下反应得到混合物;②制备
 :将
:将 溶于乙醚后与无水氯化铝反应。
溶于乙醚后与无水氯化铝反应。制备
 的实验装置如下:
的实验装置如下:
回答下列问题:
(1)实验开始,检验装置气密性,添加药品完毕,加热
 装置前应进行的操作是
装置前应进行的操作是(2)B装置中发生反应的离子方程式为
(3)制备
 的化学方程式为
的化学方程式为(4)乙醚作溶剂的优点是
(5)采用该方法制备
 的突出优点是
的突出优点是(6)
 的还原能力比
的还原能力比 更强大,原因是
更强大,原因是
您最近一年使用:0次
2024-01-13更新
|
727次组卷
|
4卷引用:湖南省株洲市第一中学2021届高三下学期第三次模拟检测化学试题
名校
解题方法
4 . 锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: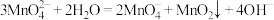 。利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略)。下列说法错误的是
。利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略)。下列说法错误的是
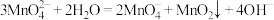 。利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略)。下列说法错误的是
。利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略)。下列说法错误的是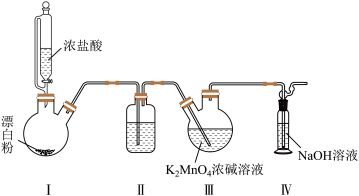
| A.在强碱性环境下,氧化性:Cl2>KMnO4 |
| B.装置Ⅰ中的漂白粉可以用MnO2代替 |
| C.装置Ⅱ中盛放浓硫酸,以提高KMnO4的产率 |
| D.装置Ⅳ不需要防倒吸的原因是氢氧化钠溶液与氯气反应速率较慢 |
您最近一年使用:0次
2023-11-11更新
|
256次组卷
|
5卷引用:湖南省株洲市第二中学2021届高三下学期第三次模拟考试化学试卷
名校
解题方法
5 . Mg3N2常用于制备其它超硬、耐高温的氮化物,实验室通过CuO氧化NH3制得N2,然后与镁反应得到Mg3N2.已知Mg+2NH3 Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法错误的是
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法错误的是
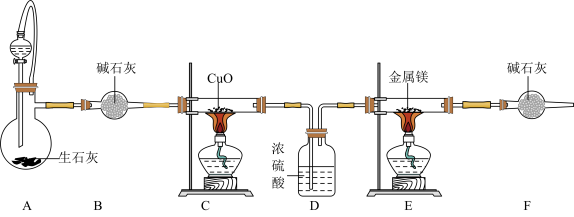
 Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法错误的是
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法错误的是
| A.装置A中分液漏斗中的溶液为浓氨水 |
| B.实验开始时应先点燃C处酒精灯,再点燃E处酒精灯 |
| C.装置D的作用只是干燥N2 |
| D.取反应后装置E所得固体少许,滴入蒸馏水,可检验是否有Mg3N2 |
您最近一年使用:0次
2023-06-27更新
|
981次组卷
|
4卷引用:广东省2021届高三下学期冲刺模拟检测化学试题
名校
解题方法
6 . 某兴趣小组利用如图所示装置制备亚氯酸钠(NaClO2)(已知:SO2与NaClO3在酸性条件下反应ClO2)。下列说法错误的是


| A.装置A中使用70%的浓硫酸效果较好 |
| B.一段时间后,装置B中有NaClO2晶体析出 |
| C.装置C中H2O2体现氧化性 |
| D.装置D用于吸收酸性尾气,防止污染空气 |
您最近一年使用:0次
2022-10-16更新
|
207次组卷
|
2卷引用:湖南省株洲市第一中学2021届高三下学期第三次模拟检测化学试题
解题方法
7 . 一种利用废铜屑制硫酸铜晶体的实验流程及主要装置如下:
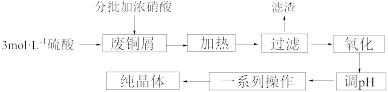

(1)盛浓硝酸的玻璃仪器名称为_______ 。写出加浓硝酸刚开始时废铜屑溶解的离子方程式_______ ,根据下图分析硝酸的用量如何影响CuSO4·5H2O产率_______

(2)废铜屑中常含有铁、铅等杂质,铅可形成硫酸铅沉淀而除去,某些氢氧化物沉淀的pH如下表所示:
试分析铁元素除去的合适的pH范围_______ ,为不引入杂质,调节pH时所加的物质为_______ 。
(3)下列有关操作的说法错误的是_______。
(4)图中“一系列操作”包含如下步骤,其正确的排序是:_______
a.自然冷却至室温
b.加热蒸发溶液至表面有晶膜出现
c. 停止过滤,取出晶体,置于滤纸上,再覆盖一-张纸,轻压吸干残液
d.用95%乙醇代替蒸馏水洗涤
e.减压过滤
(5)已知: 2Cu2+ +4I- =2CuI↓+I2,I2+ 2S2O =S4O
=S4O +2I-。称取纯晶体ag加入适量稀硫酸和水配成100mL溶液,每次取20.00mL,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,平均消耗Na2S2O3溶液b mL,则所测试样中硫酸铜晶体的纯度为
+2I-。称取纯晶体ag加入适量稀硫酸和水配成100mL溶液,每次取20.00mL,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,平均消耗Na2S2O3溶液b mL,则所测试样中硫酸铜晶体的纯度为_______ %


(1)盛浓硝酸的玻璃仪器名称为

(2)废铜屑中常含有铁、铅等杂质,铅可形成硫酸铅沉淀而除去,某些氢氧化物沉淀的pH如下表所示:
| 氢氧化钠 | 开始沉淀时的pH | 完全沉淀时的pH |
| Cu(OH)2 | 4.2 | 6.7 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
试分析铁元素除去的合适的pH范围
(3)下列有关操作的说法错误的是_______。
| A.也可在烧瓶中先加入废铜屑、水,再缓缓加入浓硫酸、浓硝酸 |
| B.若废铜屑溶解时生成的两种气体与NaOH溶液反应后只生成一种盐,则实验中n(HNO3):n(H2SO4)为1:2 |
| C.趁热过滤时,使用短颈漏斗而不用长颈漏斗 |
| D.析出CuSO4·5H2O晶体的方法同于食盐水中析出氯化钠晶体 |
a.自然冷却至室温
b.加热蒸发溶液至表面有晶膜出现
c. 停止过滤,取出晶体,置于滤纸上,再覆盖一-张纸,轻压吸干残液
d.用95%乙醇代替蒸馏水洗涤
e.减压过滤
(5)已知: 2Cu2+ +4I- =2CuI↓+I2,I2+ 2S2O
 =S4O
=S4O +2I-。称取纯晶体ag加入适量稀硫酸和水配成100mL溶液,每次取20.00mL,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,平均消耗Na2S2O3溶液b mL,则所测试样中硫酸铜晶体的纯度为
+2I-。称取纯晶体ag加入适量稀硫酸和水配成100mL溶液,每次取20.00mL,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,平均消耗Na2S2O3溶液b mL,则所测试样中硫酸铜晶体的纯度为
您最近一年使用:0次
名校
解题方法
8 . 甘氨酸亚铁[ (H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
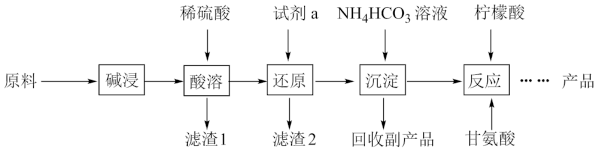
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是_________ , “滤渣1”是_________ (填化学式)
(2)“'还原”时的还原产物是_________ 。
(3)“沉淀”的离子方程式_________ ,“副产品”是_________ (写名称)
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为_________ 。
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是_________ ,某同学通过如下实验测定该补血剂中Fe2+的含量:
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是_________ 。
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为________ % (保留2位小数) 。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是
(2)“'还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为
您最近一年使用:0次
2022-08-08更新
|
993次组卷
|
7卷引用:四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题
四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题宁夏回族自治区中卫市中宁县第一中学2022-2023学年高三上学期10月月考化学试题
名校
解题方法
9 . 亚氯酸钠个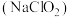 是重要消毒剂,某化学实验探究小组设计如下装置制备无水亚氯酸钠晶体。
是重要消毒剂,某化学实验探究小组设计如下装置制备无水亚氯酸钠晶体。

已知:
①纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
② 饱和溶液在低于
饱和溶液在低于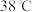 时析出
时析出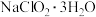 ,高于
,高于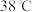 时析出无水
时析出无水 晶体,温度高于
晶体,温度高于 时,
时, 分解为
分解为 和
和 。
。
回答下列问题:
(1)仪器X的名称是_______ ;B装置的作用为_______ 。
(2)A中发生的主要反应是产生 ,写出生成
,写出生成 的化学方程式为
的化学方程式为_______ 。
(3)实验过程中,打开活塞k,缓缓通入空气,其目的①是将生成的 气体赶入后续装置中反应;②是
气体赶入后续装置中反应;②是_______ 。
(4) 气体与装置C中混合溶液反应生成
气体与装置C中混合溶液反应生成 ,生成
,生成 的离子方程式为
的离子方程式为_______ 。
(5)C装置中水浴的温度T控制在_______ (填范围),可从中获得无水 晶体。
晶体。
(6)测定产品中 的纯度,准确称取
的纯度,准确称取 样品,加入适量蒸馏水溶解、酸化,再加入过量的
样品,加入适量蒸馏水溶解、酸化,再加入过量的 晶体,发生反应
晶体,发生反应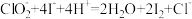 。
。
①将所得混合液稀释成 待测溶液,用酸式滴定管量取
待测溶液,用酸式滴定管量取 待测溶液置于锥形瓶中,加入淀粉溶液作指示剂,用
待测溶液置于锥形瓶中,加入淀粉溶液作指示剂,用 ,标准液滴定(已知:
,标准液滴定(已知: ),该滴定终点判断的方法是
),该滴定终点判断的方法是_______ 。
②平行滴定4次,测得消耗标准溶液体积的用量分别为 、
、 、
、 、
、 ,则样品中
,则样品中 质量百分含量为
质量百分含量为_______ (精确到小数点后二位)。
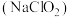 是重要消毒剂,某化学实验探究小组设计如下装置制备无水亚氯酸钠晶体。
是重要消毒剂,某化学实验探究小组设计如下装置制备无水亚氯酸钠晶体。
已知:
①纯
 易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;②
 饱和溶液在低于
饱和溶液在低于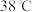 时析出
时析出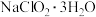 ,高于
,高于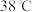 时析出无水
时析出无水 晶体,温度高于
晶体,温度高于 时,
时, 分解为
分解为 和
和 。
。回答下列问题:
(1)仪器X的名称是
(2)A中发生的主要反应是产生
 ,写出生成
,写出生成 的化学方程式为
的化学方程式为(3)实验过程中,打开活塞k,缓缓通入空气,其目的①是将生成的
 气体赶入后续装置中反应;②是
气体赶入后续装置中反应;②是(4)
 气体与装置C中混合溶液反应生成
气体与装置C中混合溶液反应生成 ,生成
,生成 的离子方程式为
的离子方程式为(5)C装置中水浴的温度T控制在
 晶体。
晶体。(6)测定产品中
 的纯度,准确称取
的纯度,准确称取 样品,加入适量蒸馏水溶解、酸化,再加入过量的
样品,加入适量蒸馏水溶解、酸化,再加入过量的 晶体,发生反应
晶体,发生反应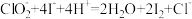 。
。①将所得混合液稀释成
 待测溶液,用酸式滴定管量取
待测溶液,用酸式滴定管量取 待测溶液置于锥形瓶中,加入淀粉溶液作指示剂,用
待测溶液置于锥形瓶中,加入淀粉溶液作指示剂,用 ,标准液滴定(已知:
,标准液滴定(已知: ),该滴定终点判断的方法是
),该滴定终点判断的方法是②平行滴定4次,测得消耗标准溶液体积的用量分别为
 、
、 、
、 、
、 ,则样品中
,则样品中 质量百分含量为
质量百分含量为
您最近一年使用:0次
2022-05-14更新
|
174次组卷
|
2卷引用:2022届江西省赣州市高三适应性考试(二模)理综化学试题
名校
10 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图所示。下列说法不正确 的是
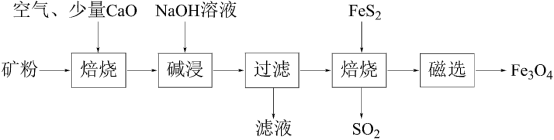

| A.“焙烧”时产生的气体可以用NaOH溶液吸收 |
| B.滤液中的铝元素主要以[Al(OH)4]-形式存在. |
| C.可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色则证明产品中含有FeO |
| D.可用磁选操作的原因是Fe3O4具有磁性 |
您最近一年使用:0次
2022-02-28更新
|
813次组卷
|
5卷引用:新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题
新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题(已下线)第十单元 化学实验基础(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)福建省南平高级中学2021-2022学年高三上学期12月月考化学试题(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)



