名校
解题方法
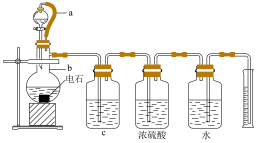
1 . 某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:_________ 。
(2)仪器b中发生反应的化学方程式为_________ ,实验过程中为了减缓水与电石的反应速率,可采取的措施是_________ (写一条即可)。
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①_______ (填“能”或“不能”)说明生成的气体全部为乙炔,原因是______ 。
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是______ (写一条即可)。
(4)为了安全,点燃乙炔前应_______ ,乙炔燃烧时的现象是____________ 。
(5)取mg电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为VmL,则电石中碳化钙的质量分数为______ (用含V和m的代数式表示,忽略导管中残留的水和气体中含有的水蒸气,所有气体均已换算成标准状况下)。
(2)仪器b中发生反应的化学方程式为
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是
(4)为了安全,点燃乙炔前应
(5)取mg电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为VmL,则电石中碳化钙的质量分数为
您最近一年使用:0次
解题方法
2 . 碱式次氯酸镁[MgmClO(OH)n·H2O]微溶于水,不潮解,相对稳定,是一种有开发价值的无机抗菌剂,以菱镁矿(MgCO3,含少量FeCO3)为主要原料,制备碱式次氯酸镁的工艺流程如下,下列说法不正确的是
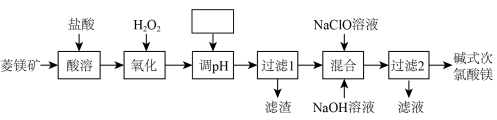
| A.流程中“酸溶”后溶液中含有Mg2+、Fe2+ |
| B.调pH时所选试剂可能是MgCO3 |
| C.“过滤1”所得的滤渣含有Fe(OH)3 |
| D.“混合”时反应的离子方程式只有Mg2++ClO-+OH-+H2O=MgClO(OH)·H2O↓ |
您最近一年使用:0次
名校
解题方法
3 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: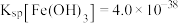 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、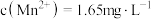 。
。
①若要除尽 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________ 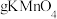 。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中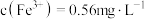 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: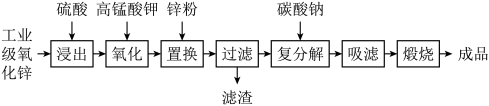
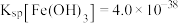 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、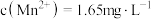 。
。①若要除尽
 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入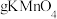 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中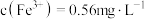 ,若溶液
,若溶液 ,则此时
,则此时
您最近一年使用:0次
2024-02-20更新
|
219次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学
黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
4 . 用下图装置进行“铁与水反应”的实验,并检验产物的性质(夹持装置略去)。回答下列问题:

(1)A装置的作用是_______ ,烧瓶底部加碎瓷片的作用是_______ 。
(2)实验开始时,应先点燃A装置中的酒精灯还是B装置中的酒精喷灯?_______ (填“A”或“B”),原因是_______ 。
(3)B中反应的化学方程式为_______ ,该反应的氧化剂是_______ 。
(4)D装置的作用是_______ 。
(5)E中的现象是_______ ,所发生反应的化学方程式是_______ 。
(6)点燃E中酒精灯之前应进行的操作是_______ 。

(1)A装置的作用是
(2)实验开始时,应先点燃A装置中的酒精灯还是B装置中的酒精喷灯?
(3)B中反应的化学方程式为
(4)D装置的作用是
(5)E中的现象是
(6)点燃E中酒精灯之前应进行的操作是
您最近一年使用:0次
名校
解题方法
5 . 综合利用粉煤灰既有利于环境保护,又有利于资源节约。某种粉煤灰(主要Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
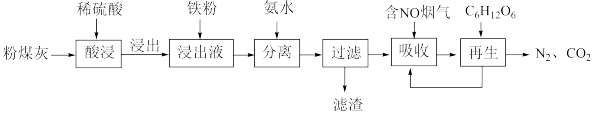
(1)①“酸浸”时Fe2O3发生反应的化学方程式_______ 。
②提高浸出率的措施有_______ (写出一点)。
③当硫酸浓度大于9.2 mol·L-1时,铝铁的浸出率下降。可能原因是_______ 。
(2)“分离”过程中加入氨水调pH的范围是_______ 。(已知:部分氢氧化物开始沉淀和沉淀完全的pH如下表所示)
若浸出液不加铁粉直接与氨水混合,铝、铁元素分离效果较差的原因是_______ 。
(3)①“分离”后所得FeSO4溶液可用于烟气中NO的吸收,生成[Fe(NO)2]2+,其反应的离子方程式为_______ 。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应,得到CO2与N2的质量之比为_______ 。

(1)①“酸浸”时Fe2O3发生反应的化学方程式
②提高浸出率的措施有
③当硫酸浓度大于9.2 mol·L-1时,铝铁的浸出率下降。可能原因是
(2)“分离”过程中加入氨水调pH的范围是
| 氢氧化物 | 氢氧化铁 | 氢氧化铝 | 氢氧化亚铁 |
| 开始沉淀的pH | 1.5 | 3.2 | 7.1 |
| 沉淀完全的pH | 3.1 | 4.9 | 8.9 |
(3)①“分离”后所得FeSO4溶液可用于烟气中NO的吸收,生成[Fe(NO)2]2+,其反应的离子方程式为
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应,得到CO2与N2的质量之比为
您最近一年使用:0次
6 . 某同学用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾FeSO4·7H2O,设计了如下流程(部分物质已略去,加入的试剂均过量):回答下列问题:
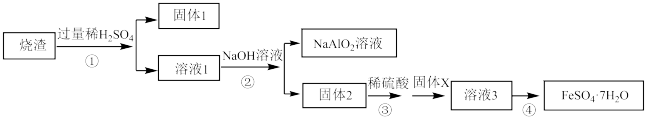
(1)固体1的主要成分为___________ (填化学式,下同),固体X为_____________ 。
(2)写出步骤②中生成固体2和NaAlO2溶液的离子方程式为_____________ 、__________
(3)某学生的过滤操作中,其操作不规范的是__________ (填标号)。
a.玻璃棒用作引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯壁
d.将滤纸湿润,使其紧贴漏斗壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)步骤①中用到的稀硫酸浓度为2mol/L,体积为1L,此稀硫酸是由18.0 mol/L的浓硫酸稀释得到,该用量筒量取__________ ml 18.0 mol/L的浓硫酸。下列操作使所配稀硫酸浓度偏大的有________ (填写字母)。
A、在烧杯中稀释浓硫酸后,未冷却就立即转移到容量瓶中
B、往容量瓶转移时,有少量液体溅出;
C、定容时俯视刻度线;
D、容量瓶未干燥即用来配制溶液;
E、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。

(1)固体1的主要成分为
(2)写出步骤②中生成固体2和NaAlO2溶液的离子方程式为
(3)某学生的过滤操作中,其操作不规范的是
a.玻璃棒用作引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯壁
d.将滤纸湿润,使其紧贴漏斗壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)步骤①中用到的稀硫酸浓度为2mol/L,体积为1L,此稀硫酸是由18.0 mol/L的浓硫酸稀释得到,该用量筒量取
A、在烧杯中稀释浓硫酸后,未冷却就立即转移到容量瓶中
B、往容量瓶转移时,有少量液体溅出;
C、定容时俯视刻度线;
D、容量瓶未干燥即用来配制溶液;
E、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
您最近一年使用:0次
解题方法
7 . ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体。下图是实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体。
(1)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,其反应的微观过程如图所示:

该反应的化学方程式为_______ 。

(2)仪器P的名称是_______ ,向其中加入图所示的浓盐酸,其物质的量浓度是_______ mol/L。

(3)写出装置A中烧瓶内发生反应的离子方程式:_______ 。

(4)B装置中所盛试剂是_______ ; C装置所盛试剂的作用是_______ 。
(5)E装置所盛试剂的作用是_______ 。
(6)F为ClO2收集装置,应选用的装置是_______ (填序号)。
(1)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,其反应的微观过程如图所示:

该反应的化学方程式为

(2)仪器P的名称是

(3)写出装置A中烧瓶内发生反应的离子方程式:

(4)B装置中所盛试剂是
(5)E装置所盛试剂的作用是
(6)F为ClO2收集装置,应选用的装置是
您最近一年使用:0次
8 . 某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO ,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):

回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:Fe+2H+=Fe2++H2↑和_______ 。
(2)试剂X可选用_______ (写一种,填化学式),“滤渣”的主要成分是_______ 、_______ 。
(3)加入碳酸氢铵后,生成FeCO3沉淀,过滤,发现滤液有些浑浊,可能的操作失误的原因是_______ 。
(4)若在实验室中灼烧FeCO3应在_______ (填仪器名称)中进行,“灼烧氧化”在空气中进行,写出该反应的化学方程式_______ 。
 ,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:Fe+2H+=Fe2++H2↑和
(2)试剂X可选用
(3)加入碳酸氢铵后,生成FeCO3沉淀,过滤,发现滤液有些浑浊,可能的操作失误的原因是
(4)若在实验室中灼烧FeCO3应在
您最近一年使用:0次
名校
9 . ClO2是一种强氧化性气体(高浓度时呈红黄色,低浓度时呈黄色),在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
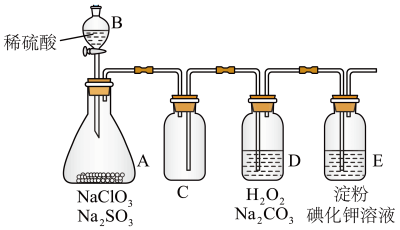
(1)图中装置有一明显错误,请指出_______ 。
(2)D中吸收ClO2后生成NaClO2、NaHCO3和_______ 。
(3)E中溶液变蓝,_______ (填“能”或“不能”)说明ClO2在D装置中未被充分吸收,理由是_______ 。
(4)提高ClO2吸收率的方法有_______ 。
A.加快滴加稀硫酸的速度
B.减缓滴加稀硫酸的速度
C.装置D、E中长导管口加装多孔球泡

(1)图中装置有一明显错误,请指出
(2)D中吸收ClO2后生成NaClO2、NaHCO3和
(3)E中溶液变蓝,
(4)提高ClO2吸收率的方法有
A.加快滴加稀硫酸的速度
B.减缓滴加稀硫酸的速度
C.装置D、E中长导管口加装多孔球泡
您最近一年使用:0次
10 . 工业上以软锰矿(主要成分为MnO2,另含有少量铁、铝等金属化合物)为原料制得高纯MnO2,然后再继续制取KMnO4,其流程如下:
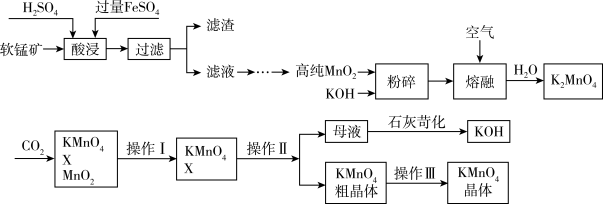
(1)实验室配制FeSO4往往会加入稀硫酸,原因是:_______ 。(结合离子方程式进行解释)
(2)由滤液制取高纯MnO2的过程中,有一步是加入氨水调节溶液pH,除去MnSO4溶液中的Al3+、Fe3+(使其浓度小于1×10-5mol/L),pH范围为_______ 。(已知:Ksp[Al(OH)3]=1×10-32,Ksp[Fe(OH)3]=1×10-38,pH=7时Mn(OH)2开始沉淀)
(3)由高纯MnO2生产K2MnO4的化学方程式为_______ 。
(4)在K2MnO4溶液中通入过量CO2气体,则X是_______ (填化学式),此时K2MnO4的理论利用率为_______ 。(保留1位小数)
(5)操作Ⅱ的名称为_______ 。
(6)上述流程中可循环使用的物质有_______ 。

(1)实验室配制FeSO4往往会加入稀硫酸,原因是:
(2)由滤液制取高纯MnO2的过程中,有一步是加入氨水调节溶液pH,除去MnSO4溶液中的Al3+、Fe3+(使其浓度小于1×10-5mol/L),pH范围为
(3)由高纯MnO2生产K2MnO4的化学方程式为
(4)在K2MnO4溶液中通入过量CO2气体,则X是
(5)操作Ⅱ的名称为
(6)上述流程中可循环使用的物质有
您最近一年使用:0次



