20-21高一下·浙江嘉兴·期末
名校
解题方法
1 . 我国“蛟龙”号载人潜水器重要部件是用钛合金材料制造的。金属钛(Ti)抗腐蚀性能好,在高温环境下具有强还原性。以金红石(主要成分为TiO2)为原料生产钛的工艺流程如下,下列说法错误的是


A.①中发生的反应:TiO2+2C+2Cl2 TiCl4+2CO TiCl4+2CO |
| B.钠可以与TiCl4溶液反应制备金属钛 |
| C.②中氩气的作用是隔绝空气,防止金属钛被氧化 |
| D.钛抗腐蚀性好是因为常温下钛与氧气化合生成一层极薄的致密氧化膜 |
您最近一年使用:0次
2022-03-18更新
|
603次组卷
|
9卷引用:课时19 金属元素为载体的化工流程选择题-2022年高考化学一轮复习小题多维练(全国通用)
(已下线)课时19 金属元素为载体的化工流程选择题-2022年高考化学一轮复习小题多维练(全国通用)浙江省嘉兴市2020-2021学年高一下学期期末考试化学试题(已下线)专题2.1.2 碳酸钠和碳酸氢钠(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)2022年1月浙江省普通高中学业水平考试化学仿真模拟试卷A新疆师范大学附属中学2021-2022学年高三9月月考化学试题广东省佛山市第一中学2021-2022学年高一上学期第二次段考化学试题(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)浙江省绍兴市上虞区2021-2022学年高一下学期期末学考适应性考试化学试题黑龙江省大庆铁人中学2023-2024学年高一上学期10月月考化学试题
2021·新疆昌吉·三模
名校
2 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图所示。下列说法不正确 的是
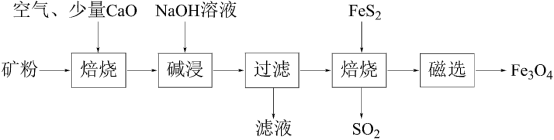

| A.“焙烧”时产生的气体可以用NaOH溶液吸收 |
| B.滤液中的铝元素主要以[Al(OH)4]-形式存在. |
| C.可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色则证明产品中含有FeO |
| D.可用磁选操作的原因是Fe3O4具有磁性 |
您最近一年使用:0次
2022-02-28更新
|
811次组卷
|
5卷引用:第十单元 化学实验基础(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)
(已下线)第十单元 化学实验基础(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题福建省南平高级中学2021-2022学年高三上学期12月月考化学试题(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)
2021·新疆昌吉·三模
解题方法
3 . 已知:普通铁+水蒸气 铁的氧化物+氢气,铁的氧化物+氢气
铁的氧化物+氢气,铁的氧化物+氢气 “引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:
“引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:

下列关于上述装置和实验的分析错误 的是
 铁的氧化物+氢气,铁的氧化物+氢气
铁的氧化物+氢气,铁的氧化物+氢气 “引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:
“引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:
下列关于上述装置和实验的分析
| A.A、Ⅰ中加入普通铁粉,G中可加入碱石灰 |
| B.A中生成磁性氧化铁,E中生成“引火铁” |
| C.需要加热的仪器只有A、E |
| D.D用于收集氢气,F处的尾气中有氢气与水蒸气 |
您最近一年使用:0次
21-22高三上·河北邢台·阶段练习
4 . 氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室用氨气和无水 (易潮解,易升华,高温下易被
(易潮解,易升华,高温下易被 氧化)在高温下反应制备CrN,反应原理为
氧化)在高温下反应制备CrN,反应原理为 ,装置如图所示。下列说法错误的是。
,装置如图所示。下列说法错误的是。

 (易潮解,易升华,高温下易被
(易潮解,易升华,高温下易被 氧化)在高温下反应制备CrN,反应原理为
氧化)在高温下反应制备CrN,反应原理为 ,装置如图所示。下列说法错误的是。
,装置如图所示。下列说法错误的是。
A.装置①还可以用于制取 、 、 、 、 等气体 等气体 |
| B.装置②、④中分别盛装NaOH溶液、NaOH固体 |
| C.装置③中也可盛装维生素C,其作用是除去氧气 |
| D.装置⑤中产生的尾气冷却后用水吸收得到HCl溶液 |
您最近一年使用:0次
21-22高三上·江西·阶段练习
名校
解题方法
5 . 钒铬渣中含有V2O3、Cr2O3及SiO2、Fe2O3、FeO等主要成分,从钒铬渣中分离提取钒、铬氧化物流程如下图:
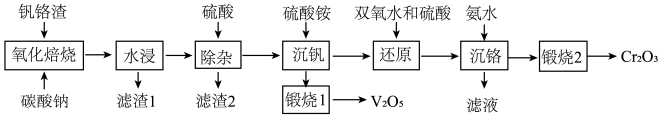
回答下列问题:
(1)钒铬渣在“氧化焙烧”之前通常要将原料粉碎,其目的是___________ 。
(2)“氧化焙烧”时,钒铬渣中化合价发生变化的元素有铬、___________ (填元素名称)。
(3)“除杂”产生的滤渣2的成分是___________ (用化学式表示)。
(4)用双氧水还原溶液中的Cr2O 时反应的离子方程式为
时反应的离子方程式为___________ ,此时溶液温度不能太高的原因是___________ 。
(5)已知“沉钒”时钒元素沉淀为+5价含氧酸的铵盐,则“煅烧1”时发生的化学反应方程式为___________ 。

回答下列问题:
(1)钒铬渣在“氧化焙烧”之前通常要将原料粉碎,其目的是
(2)“氧化焙烧”时,钒铬渣中化合价发生变化的元素有铬、
(3)“除杂”产生的滤渣2的成分是
(4)用双氧水还原溶液中的Cr2O
 时反应的离子方程式为
时反应的离子方程式为(5)已知“沉钒”时钒元素沉淀为+5价含氧酸的铵盐,则“煅烧1”时发生的化学反应方程式为
您最近一年使用:0次
2021-12-07更新
|
253次组卷
|
3卷引用:专题35 物质的检验、分离和提纯(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练
(已下线)专题35 物质的检验、分离和提纯(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练江西省七校2021-2022学年高三上学期第一次联考化学试题山西省晋城市第一中学校2023-2024学年高三上学期10月月考化学试题
2021高三·全国·专题练习
名校
6 . CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其他分解产物。
【查阅资料】
①CuCl2·2H2O CuCl2
CuCl2 CuCl+Cl2
CuCl+Cl2
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
【实验探究】该小组选用如图装置进行实验(夹持、加热仪器略)。


(1)A装置用于制取HCl:NaCl+H2SO4(浓)=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和_______ 性。
(2)按实验要求选择上图装置,连接顺序为a_______ (按气流方向,用小写字母表示)。
(3)根据完整的实验装置进行实验,实验步骤如下:①连接装置,_______ ;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是_______ 。
(4)E装置中发生反应的离子方程式是_______ 。
【实验分析与改进】
(5)B装置中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:_______ 。
(6)反应结束后,CuCl产品中可能含有少量未分解的CuCl2,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,_______ 。
【查阅资料】
①CuCl2·2H2O
 CuCl2
CuCl2 CuCl+Cl2
CuCl+Cl2②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
【实验探究】该小组选用如图装置进行实验(夹持、加热仪器略)。


(1)A装置用于制取HCl:NaCl+H2SO4(浓)=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和
(2)按实验要求选择上图装置,连接顺序为a
(3)根据完整的实验装置进行实验,实验步骤如下:①连接装置,
(4)E装置中发生反应的离子方程式是
【实验分析与改进】
(5)B装置中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:
(6)反应结束后,CuCl产品中可能含有少量未分解的CuCl2,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,
您最近一年使用:0次
21-22高三上·上海宝山·期中
名校
7 . 有一种天然黄铜矿主要成分为 (含
(含 ),为了测定该黄铜矿的纯度,某同学设计了如下实验:
),为了测定该黄铜矿的纯度,某同学设计了如下实验:

Ⅰ.称取研细的黄铁矿样品0.230g煅烧,生成Cu、 、FeO和
、FeO和 气体,实验后取d中溶液的
气体,实验后取d中溶液的 置于锥形瓶中,用
置于锥形瓶中,用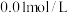 标准碘溶液进行滴定,初读数为0.10mL,末读数如图所示。完成下列填空:
标准碘溶液进行滴定,初读数为0.10mL,末读数如图所示。完成下列填空:

(1)装置c的作用是___________ ,上述反应结束后,仍需通一段时间的空气,其目的是___________ 。
(2)滴定时,标准碘溶液所耗体积为___________ 。用化学方程式表示滴定的原理___________ 。
(3)计算该黄铜矿的纯度___________ 。
Ⅱ.工业上利用黄铜矿冶炼铜产生的炉渣( 、FeO、
、FeO、 、
、 )可制备绿矾
)可制备绿矾 晶体。
晶体。
(4)选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸稀硫酸KSCN溶液 溶液和NaOH溶液。所选试剂为
溶液和NaOH溶液。所选试剂为___________ 。证明炉渣中含有FeO的实验现象为___________ 。
(5)将炉渣溶解在足量NaOH溶液中,过滤,取滤渣加入足量稀硫酸和铁屑,过滤后,将滤液___________ 、___________ 、过滤、低温烘干得到绿矾(填写实验操作名称)。
 (含
(含 ),为了测定该黄铜矿的纯度,某同学设计了如下实验:
),为了测定该黄铜矿的纯度,某同学设计了如下实验:
Ⅰ.称取研细的黄铁矿样品0.230g煅烧,生成Cu、
 、FeO和
、FeO和 气体,实验后取d中溶液的
气体,实验后取d中溶液的 置于锥形瓶中,用
置于锥形瓶中,用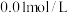 标准碘溶液进行滴定,初读数为0.10mL,末读数如图所示。完成下列填空:
标准碘溶液进行滴定,初读数为0.10mL,末读数如图所示。完成下列填空:
(1)装置c的作用是
(2)滴定时,标准碘溶液所耗体积为
(3)计算该黄铜矿的纯度
Ⅱ.工业上利用黄铜矿冶炼铜产生的炉渣(
 、FeO、
、FeO、 、
、 )可制备绿矾
)可制备绿矾 晶体。
晶体。(4)选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸稀硫酸KSCN溶液
 溶液和NaOH溶液。所选试剂为
溶液和NaOH溶液。所选试剂为(5)将炉渣溶解在足量NaOH溶液中,过滤,取滤渣加入足量稀硫酸和铁屑,过滤后,将滤液
您最近一年使用:0次
2021-12-03更新
|
218次组卷
|
3卷引用:解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)上海市吴淞中学2021-2022学年高三上学期期中考试化学试题上海市吴淞中学2022-2023学年高三上学期第一次月考化学试题
20-21高三上·山东潍坊·期末
名校
解题方法
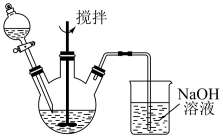
8 . 为了探究 溶液与
溶液与 溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:
溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:
Ⅰ.向盛有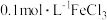 溶液的三颈瓶中,滴加一定量
溶液的三颈瓶中,滴加一定量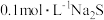 溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有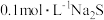 溶液的三颈瓶中,滴加少量
溶液的三颈瓶中,滴加少量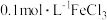 溶液,搅拌,产生沉淀B。
溶液,搅拌,产生沉淀B。
已知:① 为黑色固体,且不溶于水和盐酸。
为黑色固体,且不溶于水和盐酸。
②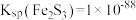 ,
, ,
,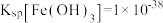 ,
, 。
。
③硫不溶于水,微溶于酒精,易溶于二硫化碳。
回答下列问题:
(1)装置中NaOH溶液的作用是___________ 。
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:
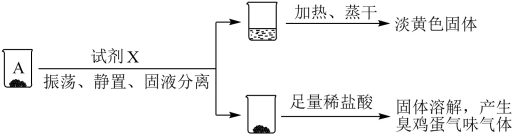
(2)试剂X是___________ 。由此推断A的成分是___________ (填化学式)。
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在 。试剂Y是NaOH溶液,明显现象是
。试剂Y是NaOH溶液,明显现象是___________ 。由此推断B的成分是___________ (填化学式)。
(4)请分析Ⅱ中实验未得到 的原因是
的原因是___________ 。
 溶液与
溶液与 溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:
溶液的反应产物,某化学兴趣小组利用如图装置进行如下实验:Ⅰ.向盛有
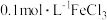 溶液的三颈瓶中,滴加一定量
溶液的三颈瓶中,滴加一定量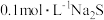 溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有
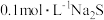 溶液的三颈瓶中,滴加少量
溶液的三颈瓶中,滴加少量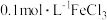 溶液,搅拌,产生沉淀B。
溶液,搅拌,产生沉淀B。已知:①
 为黑色固体,且不溶于水和盐酸。
为黑色固体,且不溶于水和盐酸。②
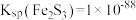 ,
, ,
,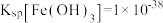 ,
, 。
。③硫不溶于水,微溶于酒精,易溶于二硫化碳。
回答下列问题:
(1)装置中NaOH溶液的作用是
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:

(2)试剂X是
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在
 。试剂Y是NaOH溶液,明显现象是
。试剂Y是NaOH溶液,明显现象是(4)请分析Ⅱ中实验未得到
 的原因是
的原因是
您最近一年使用:0次
2021-11-20更新
|
475次组卷
|
9卷引用:小题26 探究性实验——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题26 探究性实验——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)第十单元 化学实验基础(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点21 物质制备型综合实验-2020年高考化学命题预测与模拟试题分类精编广东省省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)2021年高考化学押题预测卷(福建卷)(03)(含考试版、答题卡、参考答案、全解全析)湖南省长沙市雅礼中学2021-2022学年高三上学期月考卷(三)化学试题江西省丰城中学2021-2022学年上学期高三创新实验班第四次月考化学试题山东省潍坊市2020届高三上学期期末考试化学试题山东省东营第一中学2020届高三上学期期末考试化学试题
2020·江苏南京·三模
名校
解题方法
9 . 碘化亚铜(CuI,受热易被氧化)可以作很多有机反应的催化剂。实验室可用反应2CuSO4+2KI+SO2+2H2O=2CuI↓+2H2SO4+K2SO4来制备CuI。下列实验装置和操作不能达到实验目的的是


| A.用装置甲制备SO2 | B.用装置乙制备CuI |
| C.用装置丙分离出CuI | D.用装置丁制备干燥的CuI |
您最近一年使用:0次
2021-10-26更新
|
674次组卷
|
25卷引用:热点4 化学实验的装置与操作分析-2021年高考化学专练【热点·重点·难点】
(已下线)热点4 化学实验的装置与操作分析-2021年高考化学专练【热点·重点·难点】(已下线)专题11 化学实验基础-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省济宁市2021届高三3月模拟(一模)化学试题河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题(已下线)2021年高考化学押题预测卷(福建卷)(01)(含考试版、答题卡、参考答案、全解全析)福建省南安第一中学2021届高三第二次模拟考试化学试题福建省武平县第一中学2021-2022学年高三上学期10月月考化学试题山西省运城市2021-2022学年高三上学期10月质量检测化学试题河南省部分名校2021-2022学年高三上学期10月质量检测化学试题(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)2022年北京高考真题变式题1-14(已下线)第27讲 物质的制备与性质实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题化学试题变式题(选择题1-5)(已下线)2022年北京高考真题化学试题变式题(选择题1-5)江苏省南京市2020届高三第三次模拟考试(6月) 化学试题广东省东华高级中学2021届高三上学期第二次联考化学试题福建省莆田市2021届高三毕业班第一次教学质量检测化学试卷江苏省高邮市2021-2022学年高三下学期期初学情调研化学试题江苏省南通市如东县2021-2022学年高三上学期期末学情检测化学试题(已下线)必刷卷04-2022年高考化学考前信息必刷卷(江苏专用)(已下线)押江苏卷第3题 化学实验基础知识和技能 -备战2022年高考化学临考题号押题(江苏卷)上海市2021-2022学年高三下学期第三次适应性测试 化学试题江苏省南京市宁海中学2021-2022学年高二下学期期末考试化学试题广东省清中、河中、北中、惠中、阳中五校2022-2023学年高二下学期联考化学试题福建省南平第一中学2023-2024学年高三上学期10月月考化学试题
21-22高二上·河北衡水·阶段练习
解题方法
10 . 从分金渣(主要成分为:AgCl、Ag2S、PbSO4、BaSO4)中获取高纯银的流程如图所示:

已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50。
(1)“预处理”时主要反应的化学方程式为___________ 。
(2)“分银”时AgCl与Na2SO3反应生成[Ag(SO3) 2]3-的离子方程式为___________ ,该反应的K=___________ 。(已知:Ag++2SO
 [Ag(SO3)2]3- K=1.0×108.68)
[Ag(SO3)2]3- K=1.0×108.68)
(3)“分银渣”主要成分为PbSO4、BaSO4、___________ (填化学式)。
(4)“分银”时c{[Ag(SO3)2]3-}浓度与溶液pH的关系如图1;SO 及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。
及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。
①“分银”pH应控制在___________ 范围。
②“沉银”的终点pH应控制在___________ 范围内。

(5)“还原”时HCHO转化为HCOOH,其化学方程式为___________ 。

已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50。
(1)“预处理”时主要反应的化学方程式为
(2)“分银”时AgCl与Na2SO3反应生成[Ag(SO3) 2]3-的离子方程式为

 [Ag(SO3)2]3- K=1.0×108.68)
[Ag(SO3)2]3- K=1.0×108.68)(3)“分银渣”主要成分为PbSO4、BaSO4、
(4)“分银”时c{[Ag(SO3)2]3-}浓度与溶液pH的关系如图1;SO
 及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。
及其与H+形成的微粒的浓度分数a随溶液pH变化的关系如图2。①“分银”pH应控制在
②“沉银”的终点pH应控制在

(5)“还原”时HCHO转化为HCOOH,其化学方程式为
您最近一年使用:0次



