名校
1 . 某同学用 与浓盐酸反应制备纯净的
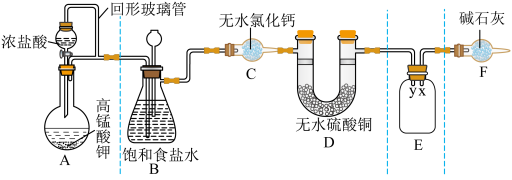
与浓盐酸反应制备纯净的 的装置如图所示。回答下列问题:
的装置如图所示。回答下列问题:
已知: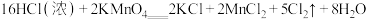
(1)装置A中盛放浓盐酸的仪器名称是
(2)E装置中导管(填“x”或“y”)
(3)装置F的作用有两个:一是
请写出氯气与碱石灰反应的化学方程式
(4)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH(即
三种微粒的物质的量分数随pH(即 )变化的关系如图所示。
)变化的关系如图所示。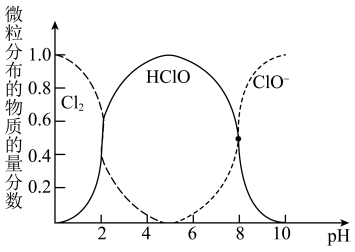
回答问题:①使用84消毒液时为增强消毒效果常调节4<pH<6,原因是
②通常购买的84消毒液pH在12左右,为增强消毒效果可向其中滴加
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(5)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为 ,计算此时所得溶液中NaClO的质量分数为
,计算此时所得溶液中NaClO的质量分数为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
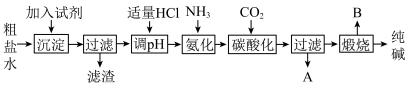
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
3 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用二氧化氯(ClO2)给自来水消毒。某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
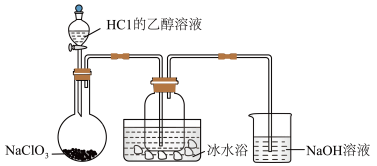
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3+4HCl =2ClO2↑+Cl2↑+2NaCl+2H2O。
(1)冰水浴的作用是_____________________ 。
(2)NaOH溶液中发生主要反应的离子方程式______________________ 。
(3)ClO2中氯元素的化合价为______ ,ClO2因其具有_______ 用于纸浆漂白、杀菌消毒。
(4)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl-除去,下列试剂中,可将ClO
),需将其转化为Cl-除去,下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是_________ (填字母序号)。
a.Fe b.O2 c.KMnO4 d.KI

资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3+4HCl =2ClO2↑+Cl2↑+2NaCl+2H2O。
(1)冰水浴的作用是
(2)NaOH溶液中发生主要反应的离子方程式
(3)ClO2中氯元素的化合价为
(4)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去,下列试剂中,可将ClO
),需将其转化为Cl-除去,下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是a.Fe b.O2 c.KMnO4 d.KI
您最近一年使用:0次
名校
解题方法
4 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图:
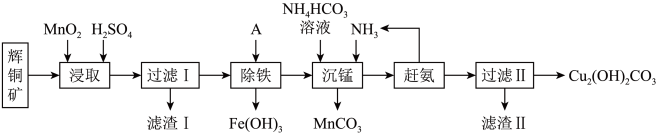
常温下,Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___________ (任写一种)。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为___________ ,若加入A后溶液的pH调为5,则溶液中Fe3+的浓度为___________ mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___________ 。
(4)“赶氨”时,最适合的操作方法是___________ 。
(5)滤液II经蒸发结晶得到的盐主要是___________ (写化学式)。
(6)过滤II得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是___________ 。

| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:
(4)“赶氨”时,最适合的操作方法是
(5)滤液II经蒸发结晶得到的盐主要是
(6)过滤II得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
名校
解题方法
5 . 实验室用 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是
 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是A.制备氯气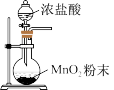 | B.收集氯气 |
C.过滤除MnO2 | D.浓缩滤液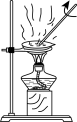 |
您最近一年使用:0次
2023-08-21更新
|
148次组卷
|
5卷引用:广东省连州市连州中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
6 . ClO2和亚氯酸钠(NaClO2)都是广泛使用的漂白剂、消毒剂。高浓度ClO2气体易发生爆炸,在生产、使用时需要用其他气体进行稀释。某工厂生产ClO2和NaClO2的工艺流程如下:

ClO2发生器中的反应为NaClO3+Na2SO3+H2SO4 Na2SO4+ClO2↑+H2O(未配平),下列有关该反应的说法中,正确的是
Na2SO4+ClO2↑+H2O(未配平),下列有关该反应的说法中,正确的是

ClO2发生器中的反应为NaClO3+Na2SO3+H2SO4
 Na2SO4+ClO2↑+H2O(未配平),下列有关该反应的说法中,正确的是
Na2SO4+ClO2↑+H2O(未配平),下列有关该反应的说法中,正确的是| A.反应中Na2SO3是氧化剂 | B.反应中ClO2是氧化产物 |
| C.每生成1个ClO2分子转1个电子 | D.参加反应的NaClO3中Cl的化合价是+1价 |
您最近一年使用:0次
名校
7 . 侯氏制碱法(联合制碱法)工艺流程可用如图表示。下列有关说法错误的是
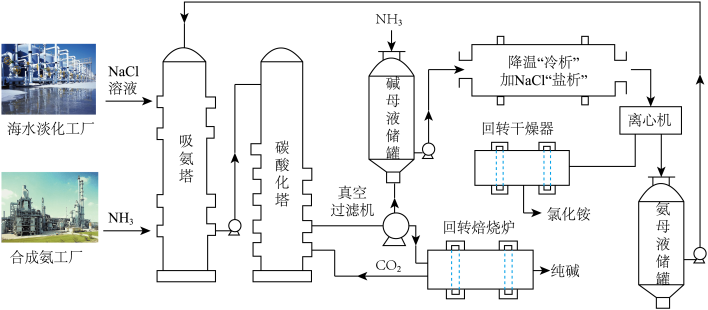

| A.以海水为原料,经分离、提纯和浓缩后得到饱和氯化钠溶液进入吸氨塔 |
B.该工艺的碳原子利用率理论上为 |
C.氨母液储罐中的溶质主要是 、 、 、 、 |
| D.在实验室模拟上述流程,“焙烧”需要使用铁坩埚、泥三角、三脚架、酒精灯等仪器 |
您最近一年使用:0次
2023-02-16更新
|
732次组卷
|
9卷引用:重庆市九龙坡区2022届高三上学期期中考试化学试题
重庆市九龙坡区2022届高三上学期期中考试化学试题重庆市育才中学校2021-2022学年高三上学期期中考试化学试题重庆市育才中学2022-2023学年高三上学期期中模拟化学试题(已下线)题型24 侯氏制碱法 上海交通大学附属中学2022-2023学年高三下学期开学摸底考试化学试题(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题11-15)(已下线)第4讲 钠及其重要化合物辽宁省沈阳市东北育才学校2022-2023学年高三高考适应性测试(二)化学试题
名校
解题方法
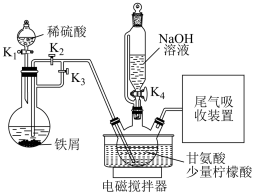
8 . 甘氨酸亚铁[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。实验室制备甘氨酸亚铁部分装置如下图(部分夹持装置省略,气密性已检查)。
ⅰ.2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
ⅱ.柠檬酸易溶于水和乙醇,有弱酸性和还原性。
ⅲ.(H2NCH2COO)2Fe易溶于水,难溶于乙醇。
下列说法错误的是
ⅰ.2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
ⅱ.柠檬酸易溶于水和乙醇,有弱酸性和还原性。
ⅲ.(H2NCH2COO)2Fe易溶于水,难溶于乙醇。
下列说法错误的是
| A.发生反应ⅰ的操作:先打开K1、K3,一段时间后关闭K1、K3,再打开K2、K4 |
| B.加入柠檬酸的作用是调节溶液的pH使反应充分发生 |
| C.反应结束后向反应混合液中加入乙醇,目的是降低甘氨酸亚铁的溶解度 |
| D.洗涤甘氨酸亚铁粗产品最好选择乙醇 |
您最近一年使用:0次
2022-12-26更新
|
224次组卷
|
5卷引用:山西省运城市2021-2022学年高三上学期期中考试化学试题
山西省运城市2021-2022学年高三上学期期中考试化学试题湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题(已下线)T13-化学实验基础(已下线)选择题11-15湖北省武汉市第三中学2023-2024学年高一上学期12月月考化学试卷
解题方法
9 . 如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。

(1)A装置为CO2的发生装置,反应的离子方程式为_____ 。
(2)B装置可除去A装置中可能挥发出的_____ ,反应的离子方程式为_____ 。
(3)C装置为O2的发生装置,反应的化学方程式为_____ 、_____ 。
(4)D装置可除去C装置中未反应的_____ ,反应的离子方程式为_____ 。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_____ 。

(1)A装置为CO2的发生装置,反应的离子方程式为
(2)B装置可除去A装置中可能挥发出的
(3)C装置为O2的发生装置,反应的化学方程式为
(4)D装置可除去C装置中未反应的
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为
您最近一年使用:0次
2022-12-19更新
|
233次组卷
|
2卷引用:甘肃省庆阳市华池县第一中学2021-2022学年高一上学期期中考试化学试题
10 . 以红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2等)为原料制备Ni(OH)2的工艺流程如图:
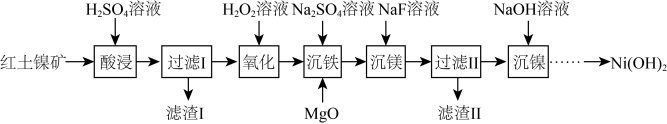
(1)“酸浸”时,加快化学反应速率的措施_______ (写一条即可)。滤渣1的成分为_______ (填化学式)。
(2)“氧化”时,Fe2+发生反应的离子方程式为_______ 。
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是_______ 。
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(5)室温时,若“沉镍”后的滤液c(Ni2+)<1×10-5mol•L-1,则滤液中pH>_______ 。(Ksp[Ni(OH)2=1×10-15)

(1)“酸浸”时,加快化学反应速率的措施
(2)“氧化”时,Fe2+发生反应的离子方程式为
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是
| 金属离子 | Fe2+ | Fe3+ | Mg2+ | Ni2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 8.9 | 6.9 |
| 沉淀完全的pH | 8.3 | 2.8 | 10.9 | 8.9 |
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(5)室温时,若“沉镍”后的滤液c(Ni2+)<1×10-5mol•L-1,则滤液中pH>
您最近一年使用:0次



