解题方法
1 . 甲、乙两个实验小组利用 酸性溶液与
酸性溶液与 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。
设计实验方案如下 实验中所用
实验中所用 溶液均已加入
溶液均已加入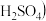 :
:
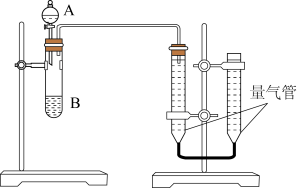
甲组:通过测定单位时间内生成 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
 该反应的离子方程式为
该反应的离子方程式为 ______
 实验开始前需要检查气密性.分液漏斗中A溶液应该
实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”
 完成该实验还需要
完成该实验还需要 ______  填仪器名称
填仪器名称 ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究 与
与 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验
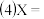
______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
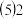 号反应中,
号反应中, 的反应速率为
的反应速率为 ______ 。
 在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,你得出的结论是 ______ 。
 从影响化学反应速率的因素看,你的猜想还可能是
从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______  填字母
填字母 。
。
A 硫酸钾 水
水  二氧化锰
二氧化锰  硫酸锰。
硫酸锰。
 酸性溶液与
酸性溶液与 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。设计实验方案如下
 实验中所用
实验中所用 溶液均已加入
溶液均已加入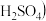 :
:甲组:通过测定单位时间内生成
 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表| 序号 | A溶液 | B溶液 |
| ① | 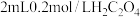 溶液 溶液 | 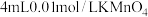 溶液 溶液 |
| ② | 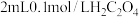 溶液 溶液 | 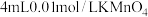 溶液 溶液 |
| ③ | 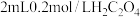 溶液 溶液 | 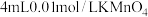 溶液和少量 溶液和少量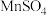 |
 该反应的离子方程式为
该反应的离子方程式为  实验开始前需要检查气密性.分液漏斗中A溶液应该
实验开始前需要检查气密性.分液漏斗中A溶液应该  填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”
 完成该实验还需要
完成该实验还需要  填仪器名称
填仪器名称 ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.乙组:通过测定
 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究 与
与 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验| 实验编号 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 | X |
 | 5 | 10 | 10 | 5 |
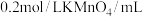 | 5 | 5 | 10 | 10 |
时间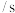 | 40 | 20 | 10 | --- |
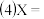
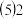 号反应中,
号反应中, 的反应速率为
的反应速率为  在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:时间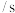 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度℃ | 25 | 26 | 26 | 26 |  | 27 | 27 |
 从影响化学反应速率的因素看,你的猜想还可能是
从影响化学反应速率的因素看,你的猜想还可能是  填字母
填字母 。
。A 硫酸钾
 水
水  二氧化锰
二氧化锰  硫酸锰。
硫酸锰。
您最近一年使用:0次
2020-01-17更新
|
168次组卷
|
2卷引用:陕西省渭南市澄城县城关中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
2 . 葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。

请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___ 。
(2)按如图连接好装置,检查气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___ 。
②一段时间后,关闭___ ,打开___ (选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___ 。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___ 。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___ 。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___ 。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___ 。

请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是
(2)按如图连接好装置,检查气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象
②一段时间后,关闭
③b中产生的气体的作用是
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是
您最近一年使用:0次
2019-12-05更新
|
1178次组卷
|
6卷引用:【全国百强校】陕西省宝鸡中学2019届高三下学期第三次模拟考试理科综合化学试题
【全国百强校】陕西省宝鸡中学2019届高三下学期第三次模拟考试理科综合化学试题2020届二轮复习 综合实验探究 专题卷(全国通用)2020届人教版高三化学二轮复习非选择题专攻练——化学实验设计与评价的综合应用1(已下线)04 常考题空4 实验简答题的精准描述 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型32 原因描述型实验(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
名校
3 . 某学习小组设计以下的实验方案,测定镁铝合金中铝的质量分数。
方案一:将m1g镁铝合金中溶解在足量的试剂X中,充分反应后,过滤、洗涤、干燥、称量,得到质量为m2 g的固体。
(1)试剂X是_____ ,反应的离子方程式是____ ;
(2)如果在实验的过程中,没有对固体进行洗涤,则测得铝的质量分数将_____ (填“偏大”“偏小”或“无影响”)。
方案二:选择如图所示的装置和药品。
(3)组装完仪器以后,需要进行的实验操作是_____ ;
(4)导管a的作用是______ ;
(5)读数时需要注意的事项有_____ ;
(6)如果合金的质量是a g,测得气体的体积为b L(已换算为标准状况时的体积),则合金中铝的质量分数是_____ 。
方案一:将m1g镁铝合金中溶解在足量的试剂X中,充分反应后,过滤、洗涤、干燥、称量,得到质量为m2 g的固体。
(1)试剂X是
(2)如果在实验的过程中,没有对固体进行洗涤,则测得铝的质量分数将
方案二:选择如图所示的装置和药品。

(3)组装完仪器以后,需要进行的实验操作是
(4)导管a的作用是
(5)读数时需要注意的事项有
(6)如果合金的质量是a g,测得气体的体积为b L(已换算为标准状况时的体积),则合金中铝的质量分数是
您最近一年使用:0次
4 . 苯和溴的取代反应的实验装置如图所示。其中A为带支管的试管改成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式:____________ 、____________ ;试管C中苯的作用____________ 。
(2)反应开始后,D、E试管的现象分别为__________________ 、____________ ; E中所发生反应的离子方程式为____________ 。
(3)在上述整套装置中,具有防倒吸作用的仪器有(填字母)____________ 。
(4)上述实验装置除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点____________ 。

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式:
(2)反应开始后,D、E试管的现象分别为
(3)在上述整套装置中,具有防倒吸作用的仪器有(填字母)
(4)上述实验装置除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点
您最近一年使用:0次
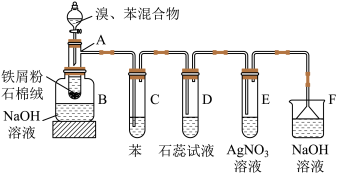
5 . 某研究小组同学用如图装置探究 与Mg的反应,实验时首先关闭K,使①中的反应进行,然后加热玻璃管③。下列说法正确的是
与Mg的反应,实验时首先关闭K,使①中的反应进行,然后加热玻璃管③。下列说法正确的是
 与Mg的反应,实验时首先关闭K,使①中的反应进行,然后加热玻璃管③。下列说法正确的是
与Mg的反应,实验时首先关闭K,使①中的反应进行,然后加热玻璃管③。下列说法正确的是
| A.②中只生成2种产物 |
| B.停止实验时,先打开K可防倒吸 |
| C.实验结束后加热④中溶液,没有明显现象 |
D.浓硫酸浓度越大生成 的速率越快 的速率越快 |
您最近一年使用:0次
名校
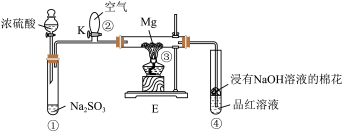
6 . 下列实验操作能达到实验目的的是
A.除去Fe(OH)3胶体中的FeCl3杂质 |
B.证明浓硫酸与蔗糖反应生成SO2 |
C.探究铁的析氢腐蚀 |
D.测定双氧水分解速率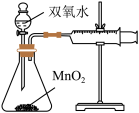 |
您最近一年使用:0次
2019-10-12更新
|
83次组卷
|
2卷引用:2019年陕西省安康市高三第一次调研考试化学试题
名校
7 . 某学习小组按如下实验过程证明了海带中存在碘元素:
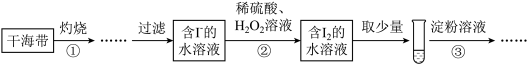
下列说法不正确的是

下列说法不正确的是
| A.步骤①需要将干海带放入蒸发皿中灼烧 |
| B.步骤②中发生反应的离子方程式为2I-+2H++H2O2=I2+2H2O |
| C.步骤③操作后,观察到试管中的溶液变为蓝色,则可说明海带中含有碘元素 |
| D.若步骤②仅滴加稀硫酸后通入氧气,则步骤③操作后,试管中的溶液也变成蓝色 |
您最近一年使用:0次
2019-08-02更新
|
359次组卷
|
3卷引用:陕西省兴平市2019-2020学年高三第一次模拟考试化学试题
名校
8 . 下列实验装置、选用的试剂或实验操作中都正确的是( )
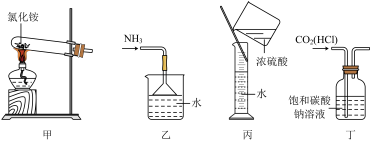

| A.实验室用装置甲制取氨 |
| B.用装置乙吸收氨,并防止倒吸 |
| C.用装置丙稀释浓硫酸 |
| D.用装置丁除去CO2中的HCl |
您最近一年使用:0次
2019-06-14更新
|
119次组卷
|
11卷引用:陕西省榆林市高新完全中学2018-2019学年高一上学期第二次月考化学试题
陕西省榆林市高新完全中学2018-2019学年高一上学期第二次月考化学试题2014-2015学年福建省晋江市季延中学高一下学期期中考试化学试卷2016届山东省华侨中学高三上学期开学考试化学试卷2016届山东省山东师范大学附属中学高三上学期一模化学试卷2016届河南省陕州中学高三上学期第一次月考化学试卷2016-2017学年山东省济南市历城区第二中学高一下学期开学考试化学试卷【全国名校大联考】2017-2018学年度高三第三次联考化学试题云南省文山州2018届高三毕业生复习统一检测理综化学试题吉林省乾安县第七中学2018-2019学年高二下学期第三次质量检测化学试题山东省新泰二中2020届高三上学期第一阶段性测试化学试题甘肃省永昌县第一高级中学2021-2022学年高三上学期期中考试化学试题
名校
9 . 下列有关实验装置进行的相应实验,不能达到实验目的的是( )
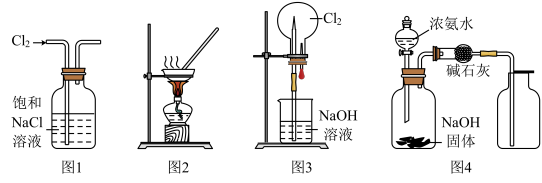

| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸发KCl溶液制备无水KCl |
| C.用图3所示装置可以完成“喷泉”实验 |
| D.用图4所示装置制取干燥纯净的NH3 |
您最近一年使用:0次
2019-06-11更新
|
366次组卷
|
4卷引用:陕西省安康市宁陕县宁陕中学2020届高三全仿真考试化学试题
名校
10 . 溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。

回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________ 。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______ (填序号)
A.NaOH溶液B.H2O
C.Na2SO3溶液D.CCl4
分离时所需的主要玻璃仪器是______________ (填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________ (填操作名称)。
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是_____________________________ 。
②鉴定生成物中乙醇的结构,可用的波谱是___________________ 和___________________ 。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式____________________________________________________ 。
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________ ,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________ 。

I.已知:NaBr+H2SO4(浓)
 NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。

回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:
A.NaOH溶液B.H2O
C.Na2SO3溶液D.CCl4
分离时所需的主要玻璃仪器是
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是
②鉴定生成物中乙醇的结构,可用的波谱是
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是

您最近一年使用:0次
2019-04-17更新
|
1129次组卷
|
3卷引用:【全国百强校】重庆市铜梁一中2018-2019学年高二下学期4月月考化学试题



