名校
1 . 下列图示实验设计或实验操作错误的是
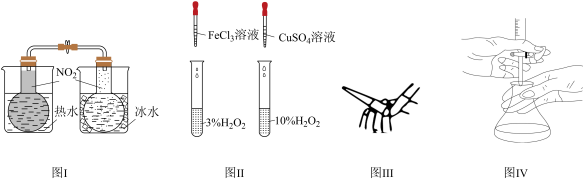

| A.图Ⅰ探究温度对化学平衡的影响 |
| B.图Ⅱ探究不同催化剂对H2O2分解速率的影响 |
| C.图Ⅲ除去碱式滴定管胶管中的气泡 |
| D.图Ⅳ用已知浓度的酸溶液滴定未知浓度的碱溶液 |
您最近一年使用:0次
2021-01-01更新
|
315次组卷
|
2卷引用:四川省成都外国语学校2020-2021学年高二12月月考化学试题
12-13高一上·吉林长春·期末
名校
2 . 下列方法中,不能用于实验室里制取氨气的是
| A.在试管中将熟石灰和氯化铵混合后加热 |
| B.加热试管中的氯化铵固体 |
| C.将烧瓶中的浓氨水加热 |
| D.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
您最近一年使用:0次
2019-04-23更新
|
534次组卷
|
14卷引用:新疆巴楚县第一中学2019-2020学年高一上学期期末考试化学试题
新疆巴楚县第一中学2019-2020学年高一上学期期末考试化学试题(已下线)2011-2012学年吉林省长春外国语学校高一上学期期末考试文科化学试卷(已下线)2011-2012学年河北省石家庄市高一上学期期末考试化学试卷2016届河北省衡水市冀州中学高三复习班上月考化学试卷2015-2016学年广东省佛山一中高一下期中化学试卷2016-2017学年广西桂林市第十八中学高一下学期开学考化学试卷2016-2017学年河北省邯郸市成安县第一中学高一下学期第一次月考化学试卷河南省永城市实验高级中学2018-2019学年高一下学期3月月考化学试题【全国百强校】黑龙江省哈尔滨市第三中学2018-2019学年高一下学期第一次阶段性测试化学试题吉林省辉南县第一中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期期中考试化学试题【校级联考】黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高一下学期期中考试(呼兰用卷)化学试题(已下线)5.2.2 氨和铵盐——同步学习必备知识四川省甘孜州康定中学2022-2023学年高一下学期3月月考化学试题
3 . 关于下列各实验或装置的叙述中,正确的是
A.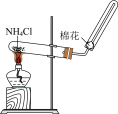 可用于制取氨气 可用于制取氨气 |
B.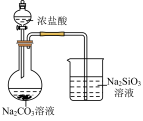 可验证酸性HCl>H2CO3>H2SiO3 可验证酸性HCl>H2CO3>H2SiO3 |
C.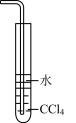 可用于吸收尾气中少量NH3或HCl,并防止倒吸 可用于吸收尾气中少量NH3或HCl,并防止倒吸 |
D. 可用于从酒精水溶液中制取无水乙醇 可用于从酒精水溶液中制取无水乙醇 |
您最近一年使用:0次
真题
名校
4 . 下列实验能达到实验目的且符合安全要求的是
A.制备氢氧化亚铁并观察其颜色 |
B.收集氧气 |
C.制备并检验氢气的可燃性 |
D.浓硫酸稀释 |
您最近一年使用:0次
2019-01-30更新
|
1556次组卷
|
11卷引用:2015-2016学年新疆哈密二中高二下期末化学试卷
2015-2016学年新疆哈密二中高二下期末化学试卷2009年普通高等学校招生统一考试理科基础化学部分(广东卷)09真题汇编-物质的制备、分离与提纯、鉴别与检验(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)2010—2011学年吉林省长春十一中高一上学期期末考试化学试卷(已下线)2012-2013学年山西省忻州一中高一12月月考化学试卷2017届宁夏石嘴山三中高三上第二次适应性考试化学卷【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题宁夏石嘴山三中2016届高三(上)第四次质检化学试卷(解析版)
名校
5 . 用下列装置进行相关实验,操作正确且能达到实验目的的是
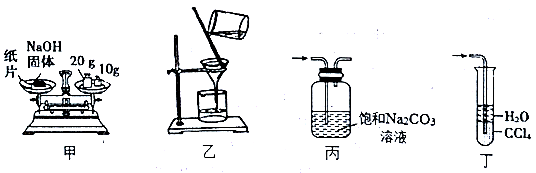

| A.甲装置:称30.0gNaOH固体 | B.乙装置: 过滤除去溶液中的不溶性杂质 |
| C.丙装置:除去CO2中混有的HCl气体 | D.丁装置: 吸收实验室制NH3的尾气 |
您最近一年使用:0次
2018-12-27更新
|
299次组卷
|
5卷引用:新疆喀什第二中学2018-2019学年高一上学期期末考试化学试题
解题方法
6 . 铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______ (用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________ nm.
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________ .
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是__________ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,_________ 、__________ (填实验操作)、干燥、称量沉淀质量为43.05g.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是________ .
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+.
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+.
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
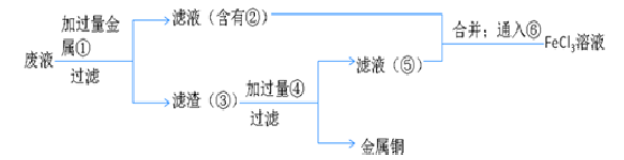
A.请写出上述实验中加入或生成的有关物质的化学式:
①__________ ;②_________ ;③__________ ;④___________ .
B.请写出通入⑥的化学方程式_____________________________
(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+.
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+.
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:
①
B.请写出通入⑥的化学方程式
您最近一年使用:0次
名校
7 . 因为氨气与氧化铜反应产物无污染,所以工业上常用氨气还原氧化铜制取铜。巴蜀中学化学兴趣小组为了模拟该反应并同时完成铜的相对原子质量的测定,设计如下所示的装置图并完成相关实验:
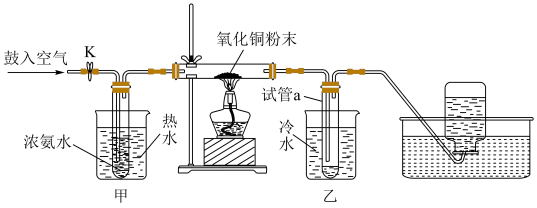
假定,测定铜的相对原子质量的实验过程中,氧化铜充分反应。以下叙述错误的是

假定,测定铜的相对原子质量的实验过程中,氧化铜充分反应。以下叙述错误的是
| A.关闭K的情况下完成实验,测得试管最终收集到的液体质量和氧化铜的质量可以求出铜的相对原子质量 |
| B.关闭K的情况下完成实验,测得氧化铜的粉末的反应前后的质量和最终集气瓶中收集到的气体体积(标准状况下)可以求出铜的相对原子质量 |
C.直型玻璃管中发生的反应为:3CuO+2NH3 N2↑+3Cu+3H2O N2↑+3Cu+3H2O |
| D.若打开K,鼓入空气,直型玻璃管中氧化铜粉末会交替出现黑色变红色,红色变黑色的现象 |
您最近一年使用:0次
2018-04-07更新
|
165次组卷
|
2卷引用:重庆市巴蜀中学2017-2018学年高一下学期3月月考化学试题
真题
名校
8 . 下列有关实验的操作正确的是
| 实验 | 操作 | |
| A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
4409次组卷
|
43卷引用:2017届新疆兵团农二师华山中学高三上学前考试化学试卷
2017届新疆兵团农二师华山中学高三上学前考试化学试卷2015-2016学年河北省景县中学高一下学期升级考试化学试卷2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2015-2016学年山东省桓台二中高二下期末化学试卷2016-2017学年山西省山西大学附中高二上9月月考化学卷2017届山东省莱州一中高三上第一次质检化学试卷2016-2017学年福建省厦门第一中学高一下学期开学考试化学试卷四川省彭州市五校2016-2017学年高二下学期期中联考化学试题2018版化学(苏教版)高考总复习专题十对接高考精练--化学实验常用仪器及基本操作江西省南昌市2018届高三摸底调研考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期第一次月考(开学考)化学试题云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题江西省抚州市临川区第一中学2017-2018学年高二下学期期中考试化学试题(已下线)《考前20天终极攻略》-5月21日 基础实验黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题(已下线)解密16 化学实验基础(教师版)——备战2018年高考化学之高频考点解密四川省眉山市眉山中学2018-2019学年高二上学期10月月考理科综合化学试题黑龙江省哈尔滨师范大学附属中学2019届高三上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题湖南省邵东县创新实验学校2019届高三上学期第五次月考化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)江西省南昌市八一中学、洪都中学、十七中、实验中学四校2018-2019学年高一下学期3月联考化学试题云南省玉溪一中2018-2019学年高一下学期期中考试化学试题 四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题浙江省金华市2018-2019学年高一上学期期末考试化学试题(已下线)专题10.1 常见仪器使用和实验基本操作(讲)-《2020年高考一轮复习讲练测》(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考江西省宜春市上高二中2021届高三上学期第一次月考化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2021届高三9月月考化学试题(已下线)【南昌新东方】1. 进贤二中 田荣达河南省安阳市实验中学2020-2021学年高一上学期阶段性考试化学试题专题3 第一单元综合拔高练-高中化学苏教2019版必修第一册上海外国语大学附属大境中学2021-2022学年高一上学期10月月考化学试卷上海市虹口区复兴高级中学2021-2022学年高一上学期期中考试化学试题广西南宁市普通高中联盟2021-2022学年高二上学期期末联考化学试题广西河池市高级中学2021-2022学年高三上学期第三次月考化学试题上海市闵行区第三中学2021-2022学年高一上学期期中考试化学试题上海市上海中学2022-2023学年高一上学期期中考试化学试题广西贺州市钟山县钟山中学2020-2021学年高一上学期期末考试化学试题广西柳州市第三中学2022-2023学年高二下学期3月月考化学试题
13-14高一下·四川雅安·期中
名校
解题方法
9 . 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为_________________________________________ 。
(2)甲同学的实验目的是_____________ ;要得出正确的实验结论,还需控制的实验条件是____________ 。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
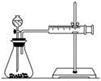
(3)乙同学在实验中应该测定的数据是___________________________________________________ 。
(4)乙同学完成该实验应选用的实验药品是________ ,该实验中不选用某浓度的硫酸,理由是___________ 。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________ 的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________ (填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是

(3)乙同学在实验中应该测定的数据是
(4)乙同学完成该实验应选用的实验药品是
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1626次组卷
|
8卷引用:新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题
新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题(已下线)2013-2014四川省雅安中学下学期期中考试高一化学试卷(已下线)2013-2014重庆市重庆一中下学期期中考试高二化学试卷(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题
11-12高二下·四川·期中
名校
10 . 下列是关于盐酸滴定氢氧化钠溶液的实验叙述:①取一锥形瓶用待测NaOH溶液润洗两次;②在锥形瓶中放入25.00mL待测液;③加入几滴石蕊试剂滴至刚变紫色立即停止;④取一只酸式滴定管,洗涤干净;⑤不润洗滴定管,直接往其中注入标准酸溶液,进行滴定;⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;⑦两眼注视滴定管内盐酸溶液液面下降,直至滴定终点。其中操作错误是
| A.④⑥⑦ | B.①⑤⑥⑦ | C.③⑤⑦ | D.①③⑤⑦ |
您最近一年使用:0次



