1 . 下列四组实验中,操作正确且能达到预期目的是
| A | B | C | D |
 | 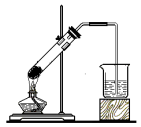 | 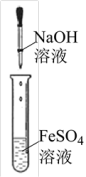 |  |
| 配制稀硫酸 | 固体NaHCO3分解 | 制备Fe(OH)2沉淀 | 铁粉与水蒸气反应产生氢气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。查阅资料:
①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
②工业制氮化铝:Al2O3+3C+N2 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑
Ⅰ.氮化铝的制备
(1)实验中使用的装置如图所示,请按照氮气气流方向将各仪器接口连接 e→c→d→_____ (装置可重复使用)
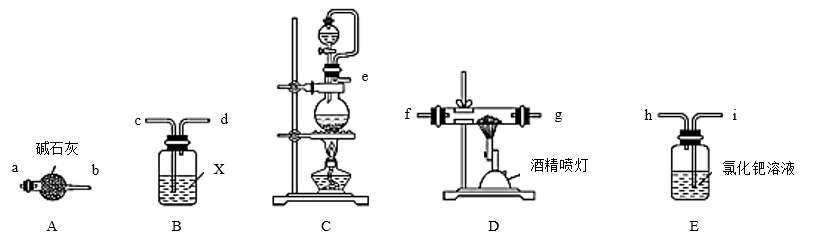
(2)B装置内的X液体可能是______ ;E装置内氯化钯溶液的作用可能是_______
Ⅱ.氮化铝纯度的测定
(方案i)甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。

(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是________ .
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)用下列仪器也能组装一套量气装置,其中必选的仪器有_________
a.单孔塞 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.烧杯
(方案ii)乙同学按以下步骤测定样品中AlN的纯度(流程如下图)
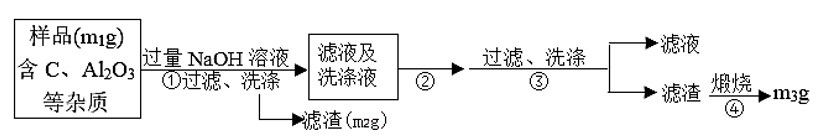
(5)步骤②的操作是_______ 。
(6)实验室灼烧滤渣,除了必要的热源和三脚架以外,还需要的硅酸盐仪器有_____ 、_____ 等。
(7)样品中AlN的纯度是______ (用含m1、m2、m3表示)。
(8)若在步骤③中未洗涤,测定结果将_____ (填“偏高”、“偏低”或“无影响”)
①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl
 NaCl+N2↑+2H2O
NaCl+N2↑+2H2O②工业制氮化铝:Al2O3+3C+N2
 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑
Ⅰ.氮化铝的制备
(1)实验中使用的装置如图所示,请按照氮气气流方向将各仪器接口连接 e→c→d→

(2)B装置内的X液体可能是
Ⅱ.氮化铝纯度的测定
(方案i)甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。

(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)用下列仪器也能组装一套量气装置,其中必选的仪器有
a.单孔塞 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.烧杯
(方案ii)乙同学按以下步骤测定样品中AlN的纯度(流程如下图)

(5)步骤②的操作是
(6)实验室灼烧滤渣,除了必要的热源和三脚架以外,还需要的硅酸盐仪器有
(7)样品中AlN的纯度是
(8)若在步骤③中未洗涤,测定结果将
您最近一年使用:0次
3 . 为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是

| A.F中可以盛放酸性KMnO4溶液 |
| B.为确认有硫酸铜生成,可向反应后的A中加水 |
| C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断 |
| D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素 |
您最近一年使用:0次
2020-05-17更新
|
178次组卷
|
5卷引用:石家庄市2020届高三年级阶段性训练题
名校
解题方法
4 . 下列装置或操作能达到目的的是
A. 装置用于测定生成氢气的速率 装置用于测定生成氢气的速率 |
B. 装置依据单位时间内颜色变化来比较浓度对反应速率的影响 装置依据单位时间内颜色变化来比较浓度对反应速率的影响 |
C. 装置依据U形管两边液面的高低判断钠和水反应的热效应 装置依据U形管两边液面的高低判断钠和水反应的热效应 |
D. 装置依据出现浑浊的快慢比较温度对反应速率的影响 装置依据出现浑浊的快慢比较温度对反应速率的影响 |
您最近一年使用:0次
2020-04-11更新
|
181次组卷
|
2卷引用:河北省唐山市第一中学2019-2020学年高一下学期第二次月考化学试题
名校
解题方法
5 . 乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
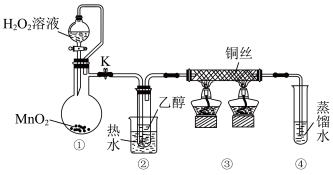

| A.①中用胶管连接其作用是平衡气压,便于液体顺利流下 |
| B.实验过程中铜丝会出现红黑交替变化 |
| C.实验开始时需先加热②,再通O2,然后加热③ |
| D.实验结束时需先将④中的导管移出,再停止加热。 |
您最近一年使用:0次
2020-04-05更新
|
1108次组卷
|
10卷引用:山东省枣庄三中、高密一中、莱西一中2020届高三下学期第一次在线联考化学试题
山东省枣庄三中、高密一中、莱西一中2020届高三下学期第一次在线联考化学试题广东省深圳中学2020届高三第六次理科综合能力测试化学试题江西省井冈山中学2020届高三四月检测理综化学试题湖北省名师联盟2020届高三第三次模拟考试化学试题江西省赣州市第一中学2019-2020学年高二下学期月考化学试题河北省保定市高碑店一中2020-2021学年高二上学期期末考试(励志班)化学试题黑龙江省绥化市明水县第一中学2020-2021学年高二4月月考化学试题(已下线)押广东卷化学第12题 物质制备与方案评价-备战2022年高考化学临考题号押题(广东卷)(已下线)专题08 化学实验基础-备战2023年高考化学母题题源解密(广东卷)第二节 醇酚 第1课时 醇
名校
解题方法
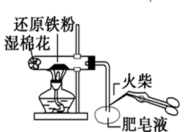
6 . 利用如图所示装置不能完成对应实验的是( )
A.图甲可以用来制备Fe(OH)3胶体 |
B.图乙可以用来证明酸性强弱顺序:H2SO4>H2CO3>H2SiO3 |
C.图丙可以通过点燃肥皂泡来检验是否有氢气气体生成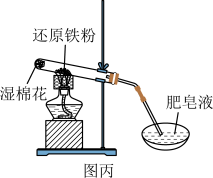 |
D.图丁可以用陶瓷坩埚加热融化NaOH固体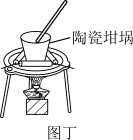 |
您最近一年使用:0次
2020-04-03更新
|
156次组卷
|
2卷引用:河北省石家庄市第一中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
7 . 某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___ 。
(2)简述银氨溶液的配制过程:___ 。
(3)步骤D应选择的加热方法是___ (填下列装置编号),理由是___ 。

(4)乙醛发生银镜反应的化学方程式___ 。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
①实验1和实验2,探究的是___ 。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___ 。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___ 。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2] 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+ Ag
Ag +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___ 。
②加入的铁粉要过量的目的是___ 。
③该实验过程中可能产生的大气污染物是___ 。
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是
(2)简述银氨溶液的配制过程:
(3)步骤D应选择的加热方法是

(4)乙醛发生银镜反应的化学方程式
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]
 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+ Ag
Ag +2NH3。
+2NH3。①写出废液与稀HNO3反应的离子方程式
②加入的铁粉要过量的目的是
③该实验过程中可能产生的大气污染物是
您最近一年使用:0次
名校
8 . 碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氢氧化钠混合液的连接顺序为__________ (按气流方向,用小写字母表示)。
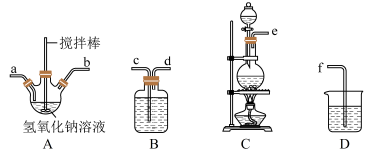
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________ 。
②制备水合肼时,应将___________ 滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
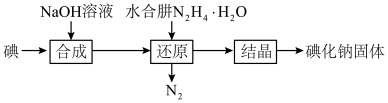
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________ 。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________ 。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________ (写名称)。
②该样品中NaI的质量分数为_______________ 。
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH
 N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3①制取次氯酸钠和氢氧化钠混合液的连接顺序为

若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
②制备水合肼时,应将
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为
②该样品中NaI的质量分数为
您最近一年使用:0次
2019-11-20更新
|
714次组卷
|
11卷引用:河北省石家庄市新华中学2020-2021学年高三上学期10月月考化学试题
河北省石家庄市新华中学2020-2021学年高三上学期10月月考化学试题江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题2020届高三《新题速递·化学》12月第02期(考点12-15)安徽省淮南市寿县第一中学2020届高三下学期周测化学试题【百强校】江西省南昌市第十中学2020届高三下学期综合模拟考试化学试题甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题安徽省滁州市定远县育才学校2020-2021学年高二下学期开学考试化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期开学考试化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题
名校
9 . 为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:
(1)操作①为______ 。
(2)操作②~④加入的试剂可以为____________ 。
(3)如何判断SO42-已除尽,简述实验操作____________ 。
(4)该同学设计的实验方案______ (填“合理”或“不合理”),理由是____________ 。
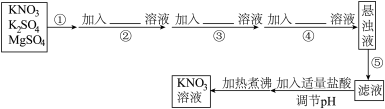
(1)操作①为
(2)操作②~④加入的试剂可以为
(3)如何判断SO42-已除尽,简述实验操作
(4)该同学设计的实验方案
您最近一年使用:0次
名校
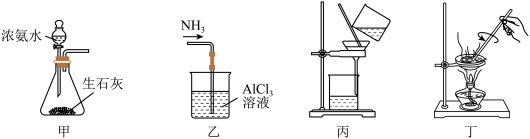
10 . 用下列装置制取 并用
并用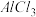 溶液吸收多余的
溶液吸收多余的 以制取
以制取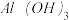 ,最后回收
,最后回收 ,能达到实验目的的是( )
,能达到实验目的的是( )
 并用
并用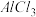 溶液吸收多余的
溶液吸收多余的 以制取
以制取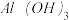 ,最后回收
,最后回收 ,能达到实验目的的是( )
,能达到实验目的的是( )
A.用装置甲制取 |
B.用装置乙吸收 以制取 以制取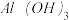 |
C.用装置丙在不断搅拌下分离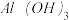 和 和 溶液 溶液 |
D.用装置丁蒸干 溶液并灼烧制取 溶液并灼烧制取 |
您最近一年使用:0次
2019-08-20更新
|
104次组卷
|
13卷引用:2015-2016学年黑龙江省实验中学高二下期末化学试卷
2015-2016学年黑龙江省实验中学高二下期末化学试卷安徽省宣城市2016-2017学年高二下学期期末调研测试化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高一上学期期末考试化学试题黑龙江省哈尔滨市122中学2017-2018学年高一上学期期末考试化学试题广东省汕头市金山中学2017-2018学年高一下学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】步步为赢 高二化学暑假作业:作业五 非金属及其化合物(已下线)2019年8月23日《每日一题》2020年高考一轮复习—— 氨的实验室制法及铵盐的性质百所名校联考-必修一模块综合检测湖南省岳阳市第一中学2019-2020学年高一下学期第一次质量检测化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷江西省宜春市宜丰中学、宜春一中联考2022-2023学年高一下学期4月期中考试化学试题江西省宜春市宜丰中学2022-2023学年高一上学期11月期中考试化学试题



