1 . 用下列装置及药品制备相应气体,能达到实验目的的是
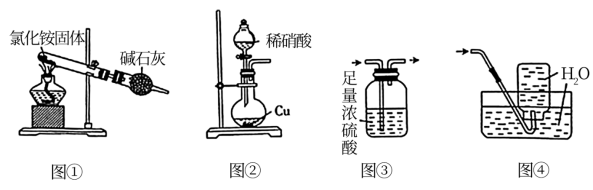

| A.用图①所示装置制备氨气 | B.用图②所示装置制备 |
C.用图③所示装置干燥 | D.用图④所示装置收集 |
您最近一年使用:0次
2021-07-14更新
|
148次组卷
|
2卷引用:甘肃省靖远县2020-2021学年高一下学期期末考试化学试题
名校
2 . 某化学兴趣小组设计装置,进行实验探究KMnO4与浓盐酸的反应。
[实验1]设计如图1所示装置,并验证氯气的漂白性。
(1)利用装置C验证氯气是否具有漂白性,则装置中I、II、III处依次放入的物质可能是___________ 。

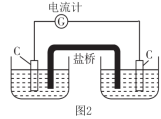
[实验2]设计如图2所示装置,左侧烧杯中加入100 mL由2.00 mol·L-1 KMnO4和6 mol·L-1 H2SO4组成的混合溶液,右侧烧杯中加入100 mL 5.00 mol·L-1 BaCl2溶液,盐桥选择KNO3琼脂。
(2)若用98%的浓硫酸(密度为1.84 g·cm-3)配制500 mL 6 mol·L-1的稀硫酸时,除了需用到玻璃棒、烧杯、量筒之外,还必须用到的玻璃仪器为___________ ;下列操作会导致所配溶液浓度偏小的是___ (填字母)。
A.容量瓶内壁附有水珠却未干燥处理
B.加水定容时俯视刻度线
C.颠倒摇匀后发现凹液面低于刻度线又加水补足
D.稀释过程中有少量液体溅出烧杯外
(3)左侧烧杯中石墨电极上的电极反应式为___________ ;盐桥中的K+移向___________ (填“左”或“右”)侧烧杯的溶液中。
(4)实验发现,其他条件不变,改用10.0 mol·L-1 H2SO4时,生成氯气的速率比使用6 mol·L-1 H2SO4时快且产生的气体体积更大,其可能的原因是___________ 。
[实验1]设计如图1所示装置,并验证氯气的漂白性。
(1)利用装置C验证氯气是否具有漂白性,则装置中I、II、III处依次放入的物质可能是


[实验2]设计如图2所示装置,左侧烧杯中加入100 mL由2.00 mol·L-1 KMnO4和6 mol·L-1 H2SO4组成的混合溶液,右侧烧杯中加入100 mL 5.00 mol·L-1 BaCl2溶液,盐桥选择KNO3琼脂。
(2)若用98%的浓硫酸(密度为1.84 g·cm-3)配制500 mL 6 mol·L-1的稀硫酸时,除了需用到玻璃棒、烧杯、量筒之外,还必须用到的玻璃仪器为
A.容量瓶内壁附有水珠却未干燥处理
B.加水定容时俯视刻度线
C.颠倒摇匀后发现凹液面低于刻度线又加水补足
D.稀释过程中有少量液体溅出烧杯外
(3)左侧烧杯中石墨电极上的电极反应式为
(4)实验发现,其他条件不变,改用10.0 mol·L-1 H2SO4时,生成氯气的速率比使用6 mol·L-1 H2SO4时快且产生的气体体积更大,其可能的原因是
您最近一年使用:0次
2020-12-31更新
|
223次组卷
|
2卷引用:甘肃省天水市一中2021届高三上学期第三学段考试化学试题
名校
3 . 苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:

(1)写出A中主要反应的化学方程式:________ 。
(2)试管C中四氯化碳的作用是_____________ 。
(3)反应开始后,观察试管D和试管E, 看到的现象分别D:____________ ; E:______________ 。
(4)仪器B中的NaOH溶液的作用是_______ ,可观察到的现象是__________ 。
(5)在上述整套装置中,除D装置具有防倒吸作用以外,还有_______ 装置(填字母) 具有防倒吸作用。

(1)写出A中主要反应的化学方程式:
(2)试管C中四氯化碳的作用是
(3)反应开始后,观察试管D和试管E, 看到的现象分别D:
(4)仪器B中的NaOH溶液的作用是
(5)在上述整套装置中,除D装置具有防倒吸作用以外,还有
您最近一年使用:0次
名校
解题方法
4 . 关于下列实验装置说法中正确的是( )
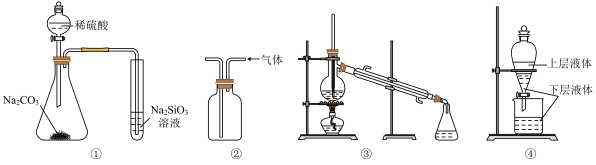

| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
| C.用图③将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 |
| D.用图④提取海带中的碘 |
您最近一年使用:0次
名校
5 . 碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氢氧化钠混合液的连接顺序为__________ (按气流方向,用小写字母表示)。
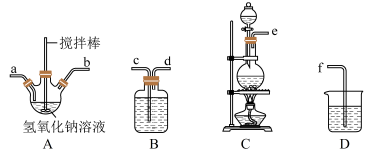
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________ 。
②制备水合肼时,应将___________ 滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
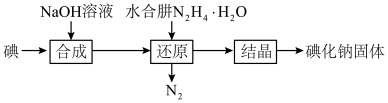
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________ 。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________ 。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________ (写名称)。
②该样品中NaI的质量分数为_______________ 。
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH
 N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3①制取次氯酸钠和氢氧化钠混合液的连接顺序为

若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
②制备水合肼时,应将
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为
②该样品中NaI的质量分数为
您最近一年使用:0次
2019-11-20更新
|
714次组卷
|
11卷引用:甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题
甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题2020届高三《新题速递·化学》12月第02期(考点12-15)安徽省淮南市寿县第一中学2020届高三下学期周测化学试题【百强校】江西省南昌市第十中学2020届高三下学期综合模拟考试化学试题河北省石家庄市新华中学2020-2021学年高三上学期10月月考化学试题安徽省滁州市定远县育才学校2020-2021学年高二下学期开学考试化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期开学考试化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题
名校
6 . 下列实验装置、选用的试剂或实验操作中都正确的是( )
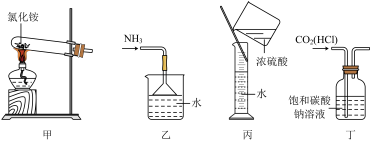

| A.实验室用装置甲制取氨 |
| B.用装置乙吸收氨,并防止倒吸 |
| C.用装置丙稀释浓硫酸 |
| D.用装置丁除去CO2中的HCl |
您最近一年使用:0次
2019-06-14更新
|
119次组卷
|
11卷引用:2014-2015学年福建省晋江市季延中学高一下学期期中考试化学试卷
2014-2015学年福建省晋江市季延中学高一下学期期中考试化学试卷2016届山东省华侨中学高三上学期开学考试化学试卷2016届山东省山东师范大学附属中学高三上学期一模化学试卷2016届河南省陕州中学高三上学期第一次月考化学试卷2016-2017学年山东省济南市历城区第二中学高一下学期开学考试化学试卷【全国名校大联考】2017-2018学年度高三第三次联考化学试题云南省文山州2018届高三毕业生复习统一检测理综化学试题陕西省榆林市高新完全中学2018-2019学年高一上学期第二次月考化学试题吉林省乾安县第七中学2018-2019学年高二下学期第三次质量检测化学试题山东省新泰二中2020届高三上学期第一阶段性测试化学试题甘肃省永昌县第一高级中学2021-2022学年高三上学期期中考试化学试题
名校
7 . 实验室用不同的实验装置研究苯与液溴的反应并制取少量溴苯。试回答下列问题:

(1)若采用图甲装置进行实验,装置A中应预先需加入的试剂是____ ,E装置的作用是___ 。
(2)若采用图乙装置进行实验,C中盛放的CCl4的作用是____________ 。
(3)若使用图乙装置,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,然后用___ (填仪器名称)分离出溴苯(仍含有少量苯)。写出有关的离子反应方程式__________ 。
(4)反应完毕后,向试管D中滴加AgNO3溶液,若有_______ (填现象)生成,说明这种获得溴苯的反应属于______ (填有机反应类型)。

(1)若采用图甲装置进行实验,装置A中应预先需加入的试剂是
(2)若采用图乙装置进行实验,C中盛放的CCl4的作用是
(3)若使用图乙装置,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,然后用
(4)反应完毕后,向试管D中滴加AgNO3溶液,若有
您最近一年使用:0次
名校
8 . 用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
(1)电石制备的乙炔气体方程式______________________________ ;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________ (填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________ ;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为_________________________ ;
(5)若没有除H2S的装置,测定结果将会____ (填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)_________ 。

(1)电石制备的乙炔气体方程式
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为
(5)若没有除H2S的装置,测定结果将会
您最近一年使用:0次
2019-04-26更新
|
195次组卷
|
2卷引用:甘肃省武威第一中学2018-2019学年高二下学期第一次阶段测试化学试题
9 . 有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸直接反应,即Cu→CuSO4,②由Cu→CuO→CuSO4,试回答:
(1)写出有关的化学反应方程式
①________________ 。
②________________ ,__________ 。
(2)这两种方案,你认为哪一种方案较合理?________________ 。
(3)请说明选择合理方案的理由:_________________ 。
(1)写出有关的化学反应方程式
①
②
(2)这两种方案,你认为哪一种方案较合理?
(3)请说明选择合理方案的理由:
您最近一年使用:0次
真题
名校
10 . 针对下列实验现象表述不正确 的是
| A.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色 |
| B.在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色 |
| C.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀 |
| D.将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成 |
您最近一年使用:0次
2019-04-12更新
|
5145次组卷
|
20卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2020届高三上学期第一次调研考试(9月)化学试题吉林省吉林市第一中学2020届高三上学期第二次调研考试(11月)化学试题2019-2020学年高三化学二轮复习选择题强化训练:实验选择题训练(三)——叙述类实验福建省福州一中2019—2020年高三上学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题山西省临汾市洪洞县第一中学2020届高三上学期期中考试化学试题四川省北大成都附属实验中学2021届高三上学期开学考试化学试题(已下线)小题必刷13 镁及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题上海交通大学附属中学2021届高三下学期3月月考化学试题河北饶阳中学2020-2021学年高一下学期第一次月考(实验部)化学试题(已下线)考点28 化学实验仪器与基本操作-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题16.化学实验仪器和基本操作-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)北京市第一六一中学2021-2022学年高三上学期期中考试化学试题



