1 . 实验室模拟工业制法从卤水中的碘(主要以I-形式存在)提取碘产品的工艺流程如下:
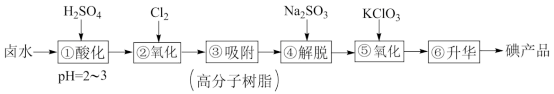
回答下列问题:
(1)实验室中常用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,所用装置如图所示:
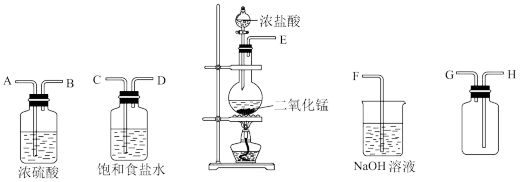
①写出气体发生装置制取氯气的化学方程式___________ 。
②连接上述仪器的正确顺序(填各接口处的字母)是:___________ 。
___________接___________;___________接___________;___________接___________;___________接___________。
③装置中,饱和食盐水的作用是___________ 。
(2)设计步骤③和④的目的是___________ 。
(3)步骤④解脱反应的离子方程式为___________ 。
(4)若②和⑤中分别得到等量I2,则消耗的m(Cl2):m(KClO3)=___________ 。

回答下列问题:
(1)实验室中常用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,所用装置如图所示:

①写出气体发生装置制取氯气的化学方程式
②连接上述仪器的正确顺序(填各接口处的字母)是:
___________接___________;___________接___________;___________接___________;___________接___________。
③装置中,饱和食盐水的作用是
(2)设计步骤③和④的目的是
(3)步骤④解脱反应的离子方程式为
(4)若②和⑤中分别得到等量I2,则消耗的m(Cl2):m(KClO3)=
您最近一年使用:0次
名校
2 . “海带提碘”中,下列关于装置和操作的说法正确的是
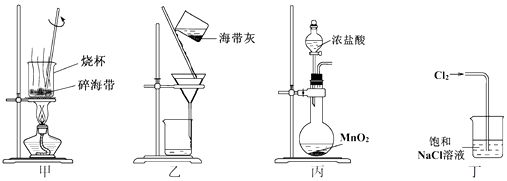

| A.用装置甲灼烧碎海带 |
| B.用装置乙过滤海带灰的浸泡液 |
| C.用装置丙制备Cl2,用于氧化浸泡液中I- |
| D.用装置丁吸收尾气中的Cl2 |
您最近一年使用:0次
2020-12-08更新
|
497次组卷
|
3卷引用:华南师范大学附属中学2021届高三综合测试二化学试题
名校
解题方法
3 . 三氯化碘(ICl3)是一种黄色晶体,遇水易分解,熔点:33℃,沸点:73℃,在药物合成中用途非常广泛。某学习小组从海带中提取碘,并用于制备三氯化碘。
(1)从干海带中提取粗碘
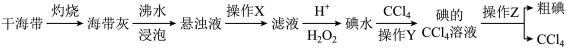
①写出加入过氧化氢后的反应的离子方程式_______ 。
②操作Y用到的玻璃仪器有烧杯、_______ 。
③可以用反萃取法将碘单质从碘的四氯化碳溶液中提取出来,写出向碘的四氯化碳溶液中加入浓氢氧化钠溶液振荡、静置、分液发生的化学方程式_______ 。
(2)利用制得的碘单质制取ICl3
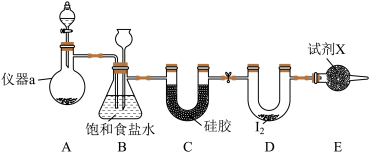
①制备氯气选用的药品为高锰酸钾和浓盐酸,相关反应的离子方程式为_______ 。
②装置B的作用_______ 。
③试剂X为_______ ,X的作用是_______ 。
④氯气与单质碘反应温度稍低于70℃,则装置D适宜的加热方式为_______ 。
(1)从干海带中提取粗碘
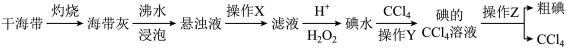
①写出加入过氧化氢后的反应的离子方程式
②操作Y用到的玻璃仪器有烧杯、
③可以用反萃取法将碘单质从碘的四氯化碳溶液中提取出来,写出向碘的四氯化碳溶液中加入浓氢氧化钠溶液振荡、静置、分液发生的化学方程式
(2)利用制得的碘单质制取ICl3

①制备氯气选用的药品为高锰酸钾和浓盐酸,相关反应的离子方程式为
②装置B的作用
③试剂X为
④氯气与单质碘反应温度稍低于70℃,则装置D适宜的加热方式为
您最近一年使用:0次
4 . 海带中含有丰富的碘元素(以I-形式存在)。工业中提取碘的流程如图:
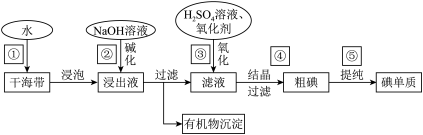
(1)写出步骤③中加硫酸溶液的目的_______ 。
(2)步骤⑤中所涉及的实验操作名称_______ 。
(3)若在实验室中,用分液漏斗、苯(密度比水小,且不溶于水)来提取碘水中的I2,加入少量苯,充分振荡静置后的现象是_______ 。
(4)检验某无色溶液中是否含有I-,所用试剂不合理的是_______ 。
A.淀粉溶液和氯水 B. KBr和稀HCl
C.氯水和四氯化碳 D. KIO3和醋酸
(5)图中有关从海带中提取碘的实验原理和装置能达到实验目的是_____

A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的氯气
D.用装置丁吸收氧化浸泡液后的尾气

(1)写出步骤③中加硫酸溶液的目的
(2)步骤⑤中所涉及的实验操作名称
(3)若在实验室中,用分液漏斗、苯(密度比水小,且不溶于水)来提取碘水中的I2,加入少量苯,充分振荡静置后的现象是
(4)检验某无色溶液中是否含有I-,所用试剂不合理的是
A.淀粉溶液和氯水 B. KBr和稀HCl
C.氯水和四氯化碳 D. KIO3和醋酸
(5)图中有关从海带中提取碘的实验原理和装置能达到实验目的是

A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的氯气
D.用装置丁吸收氧化浸泡液后的尾气
您最近一年使用:0次
名校
5 . 金属矿物资源以及海水资源的利用具有非常广阔的前景。
(1).赤铁矿(主要成分Fe2O3)冶炼得到的铁屑和海带中提取的碘可以用于生产KI,其工艺流程如图所示:
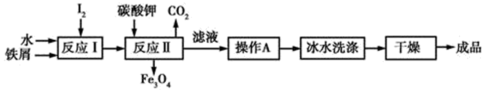
①用冰水洗涤的目的是:a. 除去附着在KI表面的可溶性杂质; b._____________ 。
②反应I生成了铁与碘的化合物X,若X中铁元素与碘元素的质量比为21:127,则X的化学式为____________ ;反应II中1 mol X完全反应生成89.6 L(标准状况)CO2,写出反应II的化学方程式:______________________ 。
(2)其课外小组在实验室设计以下装置(夹持装置已略去);进行实验,模拟海水提溴的部分过程。
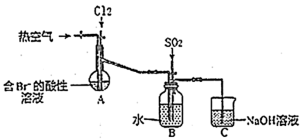
①A装置中通入Cl2气体一段时间后,停止通入,改通入热空气。通入热空气的目的是______________ 。
②反应过程中,B装置中有生成 。写出B中发生反应的离子方程式
。写出B中发生反应的离子方程式______________ 。
③该小组欲从装置B反应后的溶液中制备并分离出溴单质,实验方案为___________ (已知Br2的沸点是59℃,易溶于有机溶剂CCl4)。
(1).赤铁矿(主要成分Fe2O3)冶炼得到的铁屑和海带中提取的碘可以用于生产KI,其工艺流程如图所示:

①用冰水洗涤的目的是:a. 除去附着在KI表面的可溶性杂质; b.
②反应I生成了铁与碘的化合物X,若X中铁元素与碘元素的质量比为21:127,则X的化学式为
(2)其课外小组在实验室设计以下装置(夹持装置已略去);进行实验,模拟海水提溴的部分过程。

①A装置中通入Cl2气体一段时间后,停止通入,改通入热空气。通入热空气的目的是
②反应过程中,B装置中有生成
 。写出B中发生反应的离子方程式
。写出B中发生反应的离子方程式③该小组欲从装置B反应后的溶液中制备并分离出溴单质,实验方案为
您最近一年使用:0次
6 . Ⅰ、选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法 F.升华法
(1)______________ 分离饱和食盐水与沙子的混合物。
(2)______________ 分离水和汽油的混合物。
(3)______________ 分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4)_____________ 从碘的水溶液里提取碘。
Ⅱ、蒸馏是实验室制备蒸馏水的常用方法。

(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的错误是_____________________ 。
(2)仪器A的名称是______________ ,仪器B的名称是______________ 。
(3)实验时A中除加入少量自来水外,还需加入少量________________ ,其作用是________________________________________ 。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是_____________________________________ 。
A.萃取分液法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法 F.升华法
(1)
(2)
(3)
(4)
Ⅱ、蒸馏是实验室制备蒸馏水的常用方法。

(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的错误是
(2)仪器A的名称是
(3)实验时A中除加入少量自来水外,还需加入少量
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是
您最近一年使用:0次
名校
解题方法
7 . 某化学实验兴趣小组的同学从海带中提取碘单质的实验流程图如图:

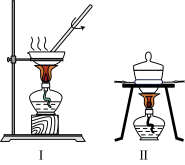
(1)完成步骤①需要装置______ 。(I 或 II)
(2)步骤③的实验操作______ 。
(3)步骤④中涉及的离子反应为______ 。
(4)海带灰中的硫酸盐、碳酸盐在步骤______ (①~⑤)中实现与 I2分离。
(5)已知在含少量 I-的溶液中,H2O2会较快分解,反应能量变化如图:

① H2O2分解过程中,I-的作用是______ 。
②加入 I-可以看到双氧水分解过程中有两个反应历程,其中第1个反应历程是______ (填“吸热”或“放热”)反应。
③有、无 I-______ (填“能”或“不能”)改变了总反应的能量变化。
(6)通过查阅资料,发现一种新型氧化剂氧化碘离子的方法如下。
I.制备新型氧化剂:利用亚硝酸钠(NaNO2)与H2O2作为混合试剂与 I-反应,制备新型氧化剂 HIO3。
II.制取 I2:在酸性条件下,氧化剂HIO3与滤液中的 I-反应生成 I2,该反应离子方程式是5I-+IO3-+6H+=3I2 +3H2O。
①1mol氧化剂 HIO3与 I-完全反应时,转移电子的物质的量是______ mol 。
②请将制备氧化剂HIO3的反应离子方程式补充完整:______ H++4______ +______ H2O2+1I-=1______ +4______ ↑+______
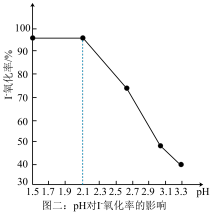
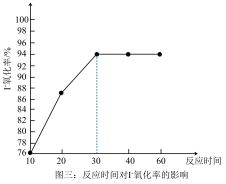
③ 某同学取一定浓度的滤液按照上述资料的方法进行实验,得到如下三组数据图象,根据图象可以得出制取碘的最佳条件______ 。


(1)完成步骤①需要装置

(2)步骤③的实验操作
(3)步骤④中涉及的离子反应为
(4)海带灰中的硫酸盐、碳酸盐在步骤
(5)已知在含少量 I-的溶液中,H2O2会较快分解,反应能量变化如图:

① H2O2分解过程中,I-的作用是
②加入 I-可以看到双氧水分解过程中有两个反应历程,其中第1个反应历程是
③有、无 I-
(6)通过查阅资料,发现一种新型氧化剂氧化碘离子的方法如下。
I.制备新型氧化剂:利用亚硝酸钠(NaNO2)与H2O2作为混合试剂与 I-反应,制备新型氧化剂 HIO3。
II.制取 I2:在酸性条件下,氧化剂HIO3与滤液中的 I-反应生成 I2,该反应离子方程式是5I-+IO3-+6H+=3I2 +3H2O。
①1mol氧化剂 HIO3与 I-完全反应时,转移电子的物质的量是
②请将制备氧化剂HIO3的反应离子方程式补充完整:
③ 某同学取一定浓度的滤液按照上述资料的方法进行实验,得到如下三组数据图象,根据图象可以得出制取碘的最佳条件



您最近一年使用:0次



