1 . 下列说法正确的是
| A.FeSO4、Fe(OH)3都可以通过化合反应制得 |
| B.往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 |
| C.氨气、溴中毒时,要立即到室外呼吸新鲜空气,必要时进行人工呼吸 |
| D.AgBr见光易分解,故可用于人工降雨 |
您最近一年使用:0次
名校
解题方法
2 . 海水资源的利用具有非常广阔的前景。
I.情景1——实验室模拟海带提碘
某化学兴趣小组在实验室模拟从海带中提取碘的实验,实验流程如图所示。
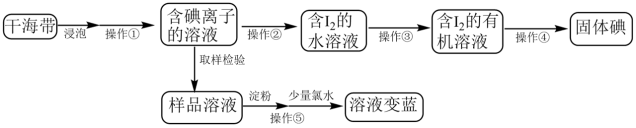
(1)提碘的原料一般选择海带或海藻,是因为_______ ,操作①的名称是_______ 。
(2)操作②为氧化,实验室一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,请写出该步骤中发生反应的离子方程式是_________ 。
(3)操作③用到的主要仪器是________ ;该步骤中加入石油醚能提取碘水中的碘,说明石油醚不溶于水,不与水反应,且______ 。操作④通过敞口挥发就能得到固体碘。
(4)操作⑤取样检验时,最好是先加入数滴淀粉溶液再逐滴加入少量氯水,请解释这样做的原因____________ 。
II.情景2——离子交换法从海带中提取碘
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
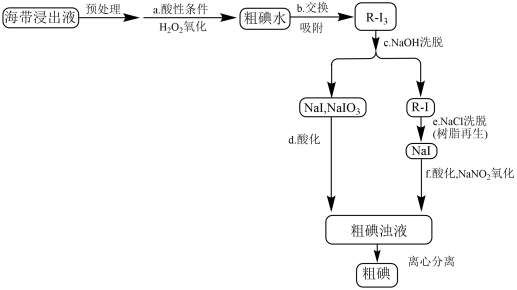
已知:①I2+I-⇌
②强碱性阴离子树脂(用R-Cl表示)对多碘离子( )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤b交换吸附时发生的反应:R-Cl+ =R-I+Cl-。
=R-I+Cl-。
试回答下列问题:
(5)图中a、b、c、d、e、f各步反应中,属于氧化还原反应的有:___________ (填序号)
(6)酸性条件下,原料被H2O2氧化时发生的反应有:①2I-+H2O2+2H+=I2+2H2O;②I2+I-⇌ 。依据整个生产流程分析是否可以加足量H2O2?说明理由。
。依据整个生产流程分析是否可以加足量H2O2?说明理由。___________
(7)图中在NaCl洗脱时离子交换树脂(表示为R-Cl)可以得到再生,并重复使用,请用化学方程式表示离子交换树脂再生的原理___________ 。
III.情景3——海水提镁
目前世界上60%的镁是从海水中提取的。已知海水提镁的主要步骤如下:
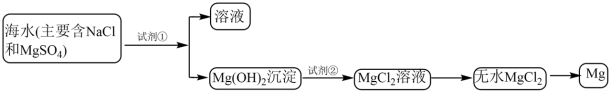
(8)为了使镁离子沉淀下来,加入的足量试剂①________ 。加入的足量试剂②是________ (填化学式)。
(9)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:MgCl2(熔融) Mg+Cl2↑,标出电子转移的方向和数目
Mg+Cl2↑,标出电子转移的方向和数目_______ 。
(10)氯气是MgCl2转化为Mg时获得的副产品,用化学方程式表示该物质的某种用途______ 。
I.情景1——实验室模拟海带提碘
某化学兴趣小组在实验室模拟从海带中提取碘的实验,实验流程如图所示。

(1)提碘的原料一般选择海带或海藻,是因为
(2)操作②为氧化,实验室一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,请写出该步骤中发生反应的离子方程式是
(3)操作③用到的主要仪器是
(4)操作⑤取样检验时,最好是先加入数滴淀粉溶液再逐滴加入少量氯水,请解释这样做的原因
II.情景2——离子交换法从海带中提取碘
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2+I-⇌

②强碱性阴离子树脂(用R-Cl表示)对多碘离子(
 )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤b交换吸附时发生的反应:R-Cl+
 =R-I+Cl-。
=R-I+Cl-。试回答下列问题:
(5)图中a、b、c、d、e、f各步反应中,属于氧化还原反应的有:
(6)酸性条件下,原料被H2O2氧化时发生的反应有:①2I-+H2O2+2H+=I2+2H2O;②I2+I-⇌
 。依据整个生产流程分析是否可以加足量H2O2?说明理由。
。依据整个生产流程分析是否可以加足量H2O2?说明理由。(7)图中在NaCl洗脱时离子交换树脂(表示为R-Cl)可以得到再生,并重复使用,请用化学方程式表示离子交换树脂再生的原理
III.情景3——海水提镁
目前世界上60%的镁是从海水中提取的。已知海水提镁的主要步骤如下:

(8)为了使镁离子沉淀下来,加入的足量试剂①
(9)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:MgCl2(熔融)
 Mg+Cl2↑,标出电子转移的方向和数目
Mg+Cl2↑,标出电子转移的方向和数目(10)氯气是MgCl2转化为Mg时获得的副产品,用化学方程式表示该物质的某种用途
您最近一年使用:0次
解题方法
3 . 请分析海水提镁、海带提碘的主要过程,按要求回答下列问题。
(1)海水提镁
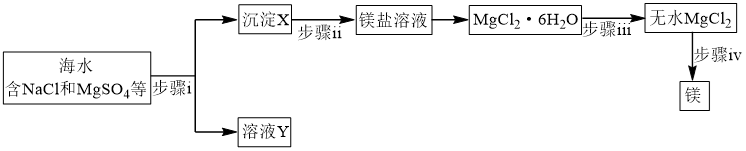
① 在周期表中位于
在周期表中位于_______ 区。
②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)_______ 溶液。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ系列操作中需在 氛围中进行原因为
氛围中进行原因为_______ 。
⑤步骤ⅳ惰性电极电解熔融 时,在
时,在_______ 极每产生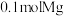 时,电路中转移电子数目为
时,电路中转移电子数目为_______ 。
(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)
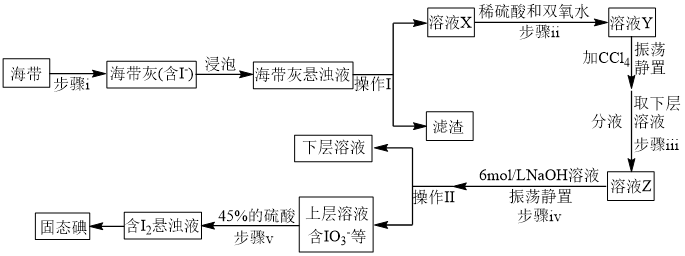
①步骤ⅰ不会用到下列仪器中的_______ (填字母)
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为_______ 、_______ 。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ到步骤Ⅴ的目的是_______ 。
⑤步骤Ⅴ中 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(1)海水提镁

①
 在周期表中位于
在周期表中位于②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)
③步骤ⅱ反应的离子方程式为
④步骤ⅲ系列操作中需在
 氛围中进行原因为
氛围中进行原因为⑤步骤ⅳ惰性电极电解熔融
 时,在
时,在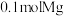 时,电路中转移电子数目为
时,电路中转移电子数目为(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)

①步骤ⅰ不会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为
③步骤ⅱ反应的离子方程式为
④步骤ⅲ到步骤Ⅴ的目的是
⑤步骤Ⅴ中
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
4 . 海带、紫菜等藻类植物含有丰富的碘元素。某化学实验小组同学从海带中提取碘并计算海带中的碘元素含量,进行以下实验:
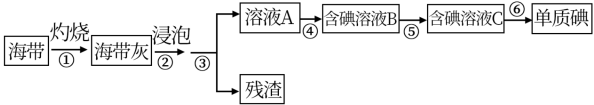
已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。乙同学认为甲的操作不合理,其理由是___________ 。
(2)海带提碘的一系列操作中需要过滤的步骤是___________ 。
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是___________ ;乙同学认为使用稀硫酸和 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由___________ 。
(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是___________ (填写字母)。
a.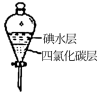 b.
b.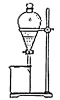
c. d.
d.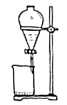
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:___________ 。
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为___________ 。

已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)海带提碘的一系列操作中需要过滤的步骤是
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是
 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是
a.
 b.
b.
c.
 d.
d.
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为
您最近一年使用:0次
2021-05-06更新
|
470次组卷
|
5卷引用:山东省枣庄市2020-2021学年高一下学期期中考试化学试题
山东省枣庄市2020-2021学年高一下学期期中考试化学试题(已下线)期末综合检测卷01【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)陕西省西安市雁塔区第二中学、渭北中学2021-2022学年高二下学期期中联考化学试题(已下线)第2章能力提升测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)山东省菏泽市单县第二中学2022-2023学年高一下学期3月段考化学试题
5 . 下列有关资源开发和利用的说法,不正确的是
| A.向浸泡过海带灰的水中加淀粉,有蓝色出现 |
B.把生铁炼成钢,需要降低生铁中硅的含量,可以在炼钢时添加 |
C.为将氨基酸混合物分离开,可以通过调节混合溶液的 值,从而析出晶体进行分离 值,从而析出晶体进行分离 |
| D.洗涤葡萄糖还原银氨溶液在试管壁产生的银,先用稀硝酸溶洗,再用水清洗 |
您最近一年使用:0次
名校
6 . 碘主要用于制药物、染料和碘化合物等,海带、紫菜等藻类植物中富含碘元素。实验室中从海带中提取碘的流程如图。
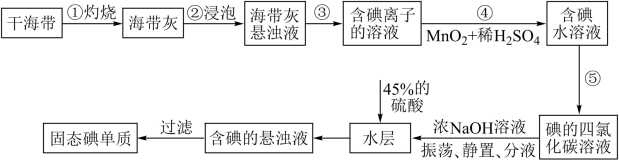
已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在___________________ (填仪器名称) 进行加热。
(2)步骤④发生反应的离子方程式为__________________ 。
(3)“过滤”操作用到的主要玻璃仪器有________________________ 。
(4)下列有关步骤⑤的叙述正确的是_________ (填序号)。
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为________________________ 。
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是______ (用离子方程式表示)。
②请用原子结构知识解释Cl2的氧化性强于I2的原因______________ 。

已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在
(2)步骤④发生反应的离子方程式为
(3)“过滤”操作用到的主要玻璃仪器有
(4)下列有关步骤⑤的叙述正确的是
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是
②请用原子结构知识解释Cl2的氧化性强于I2的原因
您最近一年使用:0次
解题方法
7 . 工业上一种从海水中制备碘的方法为:取净化除氯后的含碘海水,加入AgNO3溶液,富集得到AgI悬浊液,进而制得粗碘。从AgI悬浊液中回收I2的流程如图1所示。
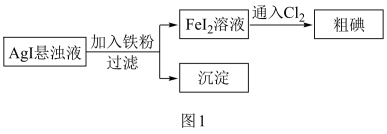
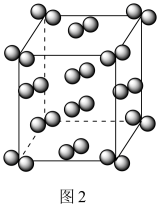
下列有关说法正确的是


下列有关说法正确的是
| A.Fe粉与AgI悬浊液反应的离子方程式为:Fe+2Ag+=Ag+Fe2+ |
| B.可在含碘海水中直接通入Cl2制备粗碘 |
| C.如图2所示I2的晶胞中有14个I2分子 |
| D.流程中沉淀可进一步转化,实现AgNO3的循环使用 |
您最近一年使用:0次
2021-11-12更新
|
385次组卷
|
3卷引用:江苏省盐城市2021-2022学年高三上学期期中考试化学试题
江苏省盐城市2021-2022学年高三上学期期中考试化学试题辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题(已下线)化学-2022年高考押题预测卷01(江苏卷)
8 . 我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。
(1)工业上海水淡化的方法有___________ 、___________ 。(填两种)
(2)空气吹出法是用于工业规模海水提溴的常用方法。其工艺流程如下:
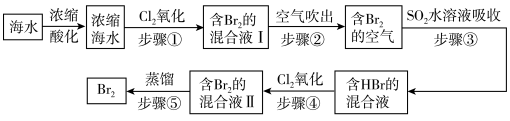
①步骤①中获得 的离子方程式为
的离子方程式为___________ 。
②根据上述反应可判断 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是___________ 。
③步骤③中若吸收剂为饱和 溶液(足量),则完全吸收
溶液(足量),则完全吸收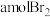 共有
共有___________ 个电子转移(用a和 的代数式表示)。
的代数式表示)。
(3)某化学兴趣小组按如下实验流程提取海带中的碘,请回答相关问题。
i.第①步是将海带放入_______ (填仪器名称)中,用酒精灯充分加热灰化。
ii.实验第④步骤后应检验碘单质的存在,具体方法是________ 。
iii.海带灰中还含有其他无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第_____ 步(填编号)与碘分离的。
iv.写出④中在酸性溶液下反应的离子方程式_______ 。
(1)工业上海水淡化的方法有
(2)空气吹出法是用于工业规模海水提溴的常用方法。其工艺流程如下:

①步骤①中获得
 的离子方程式为
的离子方程式为②根据上述反应可判断
 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是③步骤③中若吸收剂为饱和
 溶液(足量),则完全吸收
溶液(足量),则完全吸收 共有
共有 的代数式表示)。
的代数式表示)。(3)某化学兴趣小组按如下实验流程提取海带中的碘,请回答相关问题。

i.第①步是将海带放入
ii.实验第④步骤后应检验碘单质的存在,具体方法是
iii.海带灰中还含有其他无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第
iv.写出④中在酸性溶液下反应的离子方程式
您最近一年使用:0次
名校
解题方法
9 . 碘( Godine)是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素, 人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带,海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。某化学课外活动小组在实验室以海带为原料获得少量碘水,并以四氯化碳(沸点76.8℃)为溶剂将碘从碘水中提取出来,甲同学设计实验流程如图所示。请回答下列问题:
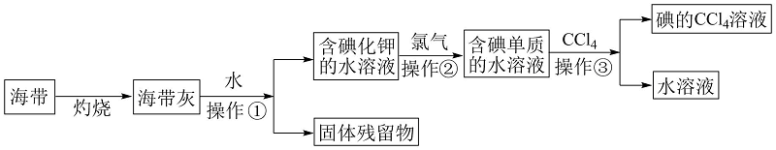
(1)上述流程中灼烧时必须用到最主要 的实验仪器有酒精灯、泥三角和___________ (填名称)。
(2)操作①的名称为___________ ;
(3)操作②中发生反应的离子方程式为______________________ ,乙同学对操作②进行了改进,用绿色氧化剂H2O2代替氯气并加适量稀盐酸,则所发生的离子反应方程式是____________________________________ 。
(4)操作③的实验名称为___________ ,最主要的 实验仪器的名称为___________ ;
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过___________ 提取了碘单质并回收CCl4(填该操作名称)
(6)目前,我国推行全民食用的加碘盐是在食盐中加入___________ 这一物质(填写化学式)。

(1)上述流程中灼烧时
(2)操作①的名称为
(3)操作②中发生反应的离子方程式为
(4)操作③的实验名称为
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过
(6)目前,我国推行全民食用的加碘盐是在食盐中加入
您最近一年使用:0次
10 . 根据流程回答问题
Ⅰ.从海带(含KI)中提取碘,某研究性学习小组设计了如图流程:
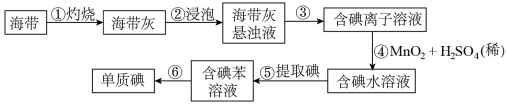
(1)步骤①中灼烧海带是在_______ (填仪器名称)中进行
(2)步骤③、⑤、⑥的实验操作分别为_______
(3)反应④的离子方程式为_______
(4)步骤⑤向碘水中加入苯,振荡静置后的现象为_______
Ⅱ.工业上用铝土矿(含有 杂质的
杂质的 ,
, 的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
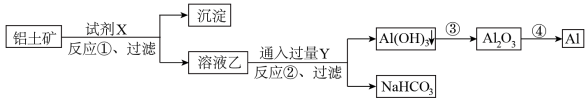
(5)试剂X是_______ (填化学式),上述反应过程中耗能最多的是_______ (填序号)
(6)反应②的离子方程式_______
(7)工业上生产1t Al,在生产过程中Al的损失率为b %,理论上需投入铝土矿_______ t(列出计算表达式即可)
Ⅰ.从海带(含KI)中提取碘,某研究性学习小组设计了如图流程:

(1)步骤①中灼烧海带是在
(2)步骤③、⑤、⑥的实验操作分别为
(3)反应④的离子方程式为
(4)步骤⑤向碘水中加入苯,振荡静置后的现象为
Ⅱ.工业上用铝土矿(含有
 杂质的
杂质的 ,
, 的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
(5)试剂X是
(6)反应②的离子方程式
(7)工业上生产1t Al,在生产过程中Al的损失率为b %,理论上需投入铝土矿
您最近一年使用:0次



