1 . 下列说法不正确 的是
| A.镀锌铁皮锌镀层厚度的测定实验:往装有镀锌铁皮的烧杯中加入足量稀硫酸,当产生气泡的速率突然减小时,可以判断锌镀层已完全反应 |
| B.从海带中提取碘的主要实验步骤为:取样→灼烧→溶解→过滤→萃取 |
| C.火柴头中氯元素的检验:将几根已燃尽的火柴头浸泡在少量水中,片刻后取少量溶液,滴加硝酸银和稀硝酸,即可判断氯元素的存在 |
D.测定 水溶液的 水溶液的 ,可用玻璃棒蘸取待测液,滴在 ,可用玻璃棒蘸取待测液,滴在 试纸上,再与比色卡对照 试纸上,再与比色卡对照 |
您最近一年使用:0次
解题方法
2 . “海水提碘”的实验中,提取后;可用“反萃取法”萃取、富集碘单质,试剂常用CCl4,实验步骤,已知:3I2+6NaOH(浓)=5NaI+NaIO3+3H2O;酸性条件下I-和IO 发生归中反应。下面说法错误的是
发生归中反应。下面说法错误的是
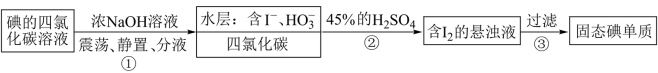
 发生归中反应。下面说法错误的是
发生归中反应。下面说法错误的是
| A.步骤①除CCl4,还可以用酒精作萃取剂 |
| B.分液时水层从分液漏斗下口放出 |
C.步骤②中发生反应的离子方程式为5I-+IO +6H+=3I2+3H2O +6H+=3I2+3H2O |
| D.步骤③操作中需要的玻璃仪器为漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
解题方法
3 . 如图所示实验操作正确的是
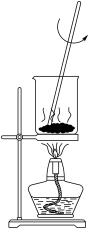 | 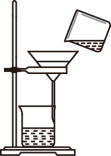 | 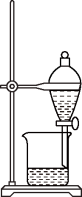 | 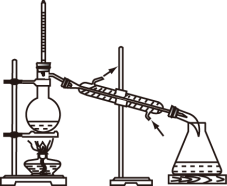 |
| 甲 | 乙 | 丙 | 丁 |
| A.图甲,将海带灼烧成灰 | B.图乙,分离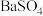 与 与 溶液 溶液 |
| C.图丙,放出溴的苯溶液 | D.图丁,分离溴苯和苯的混合物 |
您最近一年使用:0次
解题方法
4 . 下列说法不正确 的是
| A.工业制硝酸时在吸收塔用浓硝酸吸收二氧化氮获得硝酸 |
| B.炼铁时,焦炭不仅提供CO,还用燃烧产生的热量维持高温 |
| C.通常以海产品(如海带、紫菜等)为原料提取碘 |
| D.氯化镁溶液蒸发结晶可获得MgCl2·6H2O |
您最近一年使用:0次
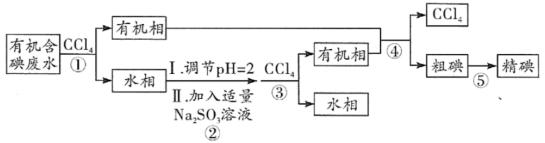
5 . 实验室用有机含碘(主要以 和
和 的形式存在)废水制备单质碘的工艺流程如图所示,下列说法错误的是
的形式存在)废水制备单质碘的工艺流程如图所示,下列说法错误的是
 和
和 的形式存在)废水制备单质碘的工艺流程如图所示,下列说法错误的是
的形式存在)废水制备单质碘的工艺流程如图所示,下列说法错误的是
| A.碘是人体必需微量元素,但不宜摄入过多 |
| B.经操作③后得到的水相不可直接排放 |
C.操作②中 发生的是还原反应 发生的是还原反应 |
| D.粗碘可采用升华法提纯为精碘 |
您最近一年使用:0次
6 . 海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:
海带 海带灰
海带灰 悬浊液
悬浊液 含I-的水溶液
含I-的水溶液 含I2的溶液
含I2的溶液 含I2的CCl4溶液
含I2的CCl4溶液 晶体碘
晶体碘
(1)步骤c的操作方法是___________ ;除烧杯外,还需要使用的玻璃仪器是___________ 、___________ 。
(2)最后的蒸馏通常用水浴加热而不是用酒精灯火焰直接加热,其原因为___________ 。
(3)骤e的操作方法叫做___________ ,所用的主要实验仪器是___________ ,最初从该仪器流出的液体颜色为___________ 色。

海带
 海带灰
海带灰 悬浊液
悬浊液 含I-的水溶液
含I-的水溶液 含I2的溶液
含I2的溶液 含I2的CCl4溶液
含I2的CCl4溶液 晶体碘
晶体碘(1)步骤c的操作方法是
(2)最后的蒸馏通常用水浴加热而不是用酒精灯火焰直接加热,其原因为
(3)骤e的操作方法叫做
您最近一年使用:0次
7 . 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
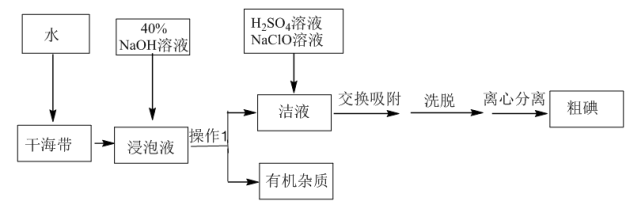
已知: 交换吸附原理:
交换吸附原理: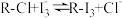 。试回答下列问题:
。试回答下列问题:
(1)操作Ⅰ的正确图示为_______。
(2)在清液中加入 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因_______ 。
(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂( 表示),待溶液转化原理为:
表示),待溶液转化原理为: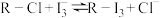 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
第一步:取8~10%的 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
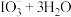 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。
第二步:取10%的 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是_______ 。
②往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式_______ 。
(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准 溶液进行滴定,重复3次
溶液进行滴定,重复3次
d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液 溶液于其中
溶液于其中
e.计算标准液的浓度
f.空白实验
过程中涉及的反应过程如下:
供试品(氧化性物质)
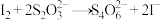

①上述操作合理的顺序是:_______ 。
 _______
_______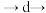 _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)
②碘量瓶加盖并加纯水液封的主要目的是_______ 。
③已知 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会_______ 。(填“偏大”、“偏小”或“不变”)

已知:
 交换吸附原理:
交换吸附原理: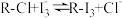 。试回答下列问题:
。试回答下列问题:(1)操作Ⅰ的正确图示为_______。
A. | B.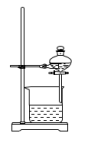 | C.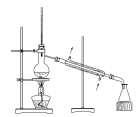 | D.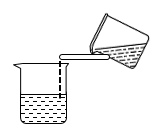 |
 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂(
 表示),待溶液转化原理为:
表示),待溶液转化原理为: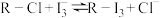 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行第一步:取8~10%的
 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
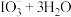 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。第二步:取10%的
 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: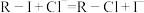 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对
 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是②往氯化钠洗脱液中滴加
 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准
 溶液进行滴定,重复3次
溶液进行滴定,重复3次d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液
 溶液于其中
溶液于其中e.计算标准液的浓度
f.空白实验

过程中涉及的反应过程如下:
供试品(氧化性物质)

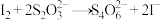

①上述操作合理的顺序是:
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)②碘量瓶加盖并加纯水液封的主要目的是
③已知
 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
您最近一年使用:0次
名校
8 . 海带中含有较多的碘元素,某化学兴趣小组通过以下步骤提取海带中的碘:
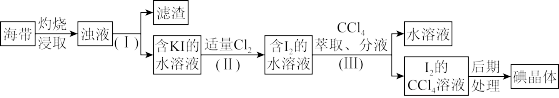
(1)步骤(Ⅰ)中分离操作的名称是_______ ,该操作中用到的玻璃仪器有漏斗、烧杯和_______ 。
(2)写出步骤(Ⅱ)中KI和Cl2反应的离子方程式_______ ,取少量反应后的溶液滴入淀粉试液,溶液呈_______ 色;
(3)步骤(Ⅲ)中萃取后分层, 的
的 溶液在
溶液在_______ (填“上层”或“下层”)。
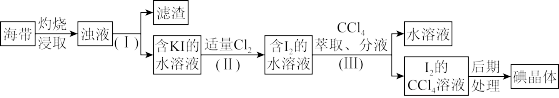
(1)步骤(Ⅰ)中分离操作的名称是
(2)写出步骤(Ⅱ)中KI和Cl2反应的离子方程式
(3)步骤(Ⅲ)中萃取后分层,
 的
的 溶液在
溶液在
您最近一年使用:0次
2022-04-20更新
|
117次组卷
|
2卷引用:福建省泉州市第七中学 2020--2021 学年高二上学期期末化学学业水平合格性测试二
解题方法
9 . 实验室中利用海带制取少量碘的CCl4溶液的实验操作包括:①灼烧海带;②溶解灰烬;③过滤;④氧化I-;⑤萃取、分液。上述实验操作中,不需要的实验仪器是
A. | B. | C.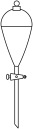 | D. |
您最近一年使用:0次
解题方法
10 . 碘是人体必需的微量元素,幼儿缺碘可导致发育迟缓、呆傻等多种疾病。海带中含有较多的碘元素,以下是从海带中提取碘并测定碘含量的实验方案。
提示:海带灰中碘元素以 形式存在。
形式存在。
实验一:海带中碘元素的检验
步骤Ⅰ:准确称取20.0g干海带,去除表面附着物、洗净、剪碎,用酒精浸润,灼烧完全至灰烬,停止加热、冷却。
步骤Ⅱ:将海带灰全部转移到小烧杯中,加入 蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至
蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至 容量瓶中定容。
容量瓶中定容。
步骤Ⅲ:取步骤IⅡ容量瓶中的溶液 于试管中,加入几滴
于试管中,加入几滴
 溶液酸化,再加入
溶液酸化,再加入 3%的
3%的 溶液和几滴淀粉溶液,观察现象。
溶液和几滴淀粉溶液,观察现象。
实验二:海带中碘元素含量的测定
步骤Ⅳ:取步骤Ⅱ容量瓶中溶液 于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入
于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入 10%
10% 溶液,摇匀,立即用
溶液,摇匀,立即用 的
的 标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗
标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗 标准溶液
标准溶液 。
。
涉及的有关反应有:①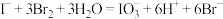
②
③
请按要求完成下列问题:
(1)步骤Ⅰ中用酒精浸润海带的作用是_______ ,灼烧海带的实验中需要的实验仪器有酒精灯、铁架台、泥三角、玻璃棒和_______ (填仪器名称)。
(2)说明海带中有碘元素的实验现象是_______ ,写出步骤中发生的离子反应方程式_______ 。
(3)根据以上数据计算每千克海带中含碘量约为_______  。
。
提示:海带灰中碘元素以
 形式存在。
形式存在。实验一:海带中碘元素的检验
步骤Ⅰ:准确称取20.0g干海带,去除表面附着物、洗净、剪碎,用酒精浸润,灼烧完全至灰烬,停止加热、冷却。
步骤Ⅱ:将海带灰全部转移到小烧杯中,加入
 蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至
蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至 容量瓶中定容。
容量瓶中定容。步骤Ⅲ:取步骤IⅡ容量瓶中的溶液
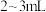 于试管中,加入几滴
于试管中,加入几滴
 溶液酸化,再加入
溶液酸化,再加入 3%的
3%的 溶液和几滴淀粉溶液,观察现象。
溶液和几滴淀粉溶液,观察现象。实验二:海带中碘元素含量的测定
步骤Ⅳ:取步骤Ⅱ容量瓶中溶液
 于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入
于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入 10%
10% 溶液,摇匀,立即用
溶液,摇匀,立即用 的
的 标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗
标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗 标准溶液
标准溶液 。
。涉及的有关反应有:①
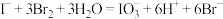
②

③

请按要求完成下列问题:
(1)步骤Ⅰ中用酒精浸润海带的作用是
(2)说明海带中有碘元素的实验现象是
(3)根据以上数据计算每千克海带中含碘量约为
 。
。
您最近一年使用:0次



