北京专家2020届高三高考模拟试卷(二)化学试题
北京
高三
模拟预测
2020-05-30
928次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、物质结构与性质、有机化学基础、常见无机物及其应用、化学实验基础、化学反应原理
北京专家2020届高三高考模拟试卷(二)化学试题
北京
高三
模拟预测
2020-05-30
928次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、物质结构与性质、有机化学基础、常见无机物及其应用、化学实验基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
| A.浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品 |
| B.我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅 |
| C.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应 |
| D.误食重金属盐引起的人体中毒,可喝大量的食盐水解毒 |
【知识点】 化学在工业中的应用
您最近一年使用:0次
2017-12-11更新
|
1199次组卷
|
9卷引用:湖南省浏阳一中、株洲二中等湘东五校2018届高三12月联考化学试题
单选题
|
适中(0.65)
2. 设 表示阿伏加 德罗常数的值,下列说法正确的是
表示阿伏加 德罗常数的值,下列说法正确的是
 表示阿伏加 德罗常数的值,下列说法正确的是
表示阿伏加 德罗常数的值,下列说法正确的是A.常温下 的 的 溶液中 溶液中 与 与 数目均为 数目均为 |
B. 葡萄糖和果糖的混合物中含羟基数目为 葡萄糖和果糖的混合物中含羟基数目为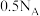 |
C.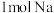 与足量 与足量 反应,生成 反应,生成 和 和 的混合物,Na失去 的混合物,Na失去 个电子 个电子 |
D.室温下,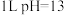 的 的 溶液中,由水电离的 溶液中,由水电离的 数目为 数目为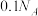 |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
3. 短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol • L -1t 溶液与 0.1 mol • L -1 u 溶液的pH均为1。下列说法不正确 的是


| A.Y、W的最高价氧化物对应的水化物均为强酸 |
| B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y |
| C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2 |
D.v的电子式可表示为 |
您最近一年使用:0次
2020-02-24更新
|
287次组卷
|
3卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 下列关于有机物的说法正确的是
| A.乙醇和丙三醇互为同系物 |
B.二环己烷( 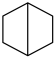 )的二氯代物有7种结构(不考虑立体异构) )的二氯代物有7种结构(不考虑立体异构) |
C.按系统命名法,化合物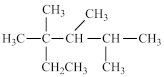 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 |
D.环己烯( )分子中的所有碳原子共面 )分子中的所有碳原子共面 |
您最近一年使用:0次
2020-02-24更新
|
514次组卷
|
5卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
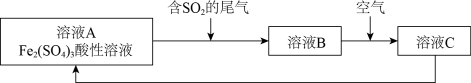

| A.向B溶液中滴加KSCN溶液,溶液可能会变为红色 |
| B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
| C.溶液酸性:A>B>C |
D.加氧化亚铁可以使溶液C转化为溶液 |
您最近一年使用:0次
2023-01-27更新
|
670次组卷
|
15卷引用:2014届福建省福州市高三毕业班质检(第一次)理综化学试卷
(已下线)2014届福建省福州市高三毕业班质检(第一次)理综化学试卷2017届重庆市第八中学高三上学期定时训练6化学试卷2017届湖南省益阳市箴言中学高三上学期第二次月考化学试卷2016-2017学年湖南省长沙市第一中学高一下学期第一次月考化学试卷山东省泰安市第一中学2020届高三10月月考化学试题山东省泰安市宁阳县第一中学2020届高三上学期第二次段考化学试题山东省泰安市第四中学2020届高三上学期期中考试化学试题四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题湖北省黄冈中学2020届高三化学测试北京专家2020届高三高考模拟试卷(二)化学试题(已下线)第11讲 硫及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)四川省泸州市泸县第一中学2022-2023学年高三上学期期末考试化学试题(已下线)第四章 非金属及其化合物 第20练 硫及其氧化物辽宁省大连市2022-2023学年高一3月月考化学试题浙江省杭州学军中学2023-2024学年高一上学期期末模拟考试化学试卷
单选题
|
适中(0.65)
名校
解题方法
6. 控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
| 选项 | A | B | C | D |
| 装置图 |  |  |  |  |
| 现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
| 结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3和SO2 | 非金属性:C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-02-24更新
|
391次组卷
|
4卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L−1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。Xn−表示Cl−或
的水解)。Xn−表示Cl−或 。下列叙述正确的是
。下列叙述正确的是
 的水解)。Xn−表示Cl−或
的水解)。Xn−表示Cl−或 。下列叙述正确的是
。下列叙述正确的是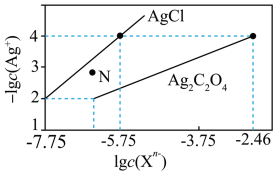
| A.Ksp(Ag2C2O4)的数量级为10−7 |
| B.N点表示AgCl的不饱和溶液 |
C.向c(Cl−)=c( )的混合溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 )的混合溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 |
D.常温下,Ag2C2O4(s)+2Cl−(aq)  2AgCl(s)+ 2AgCl(s)+ (aq)的平衡常数为109.04 (aq)的平衡常数为109.04 |
您最近一年使用:0次
2022-01-25更新
|
2054次组卷
|
26卷引用:专题十二 水溶液中的离子平衡(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
(已下线)专题十二 水溶液中的离子平衡(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训北京专家2020届高三高考模拟试卷(二)化学试题四川省雅安市2020届高三第三次诊断理综化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时2 Ksp图象及其相关计算高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时2 Ksp图像及其相关计算重庆市云阳江口中学校2021届高三上学期第二次月考化学试题湖北省沙市中学2020-2021学年高二上学期期末考试化学试题四川大学附属中学新城分校高2021届高三上学期期末考试理综化学试题天津市和平区2021届高三第三次模拟考试化学试题江西省赣州市信丰中学2020-2021学年高三上学期第五次月考化学试题四川省遂宁市射洪中学2020—2021学年高二下学期第三次月考化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析(已下线)第24讲 沉淀溶解平衡(练) — 2022年高考化学一轮复习讲练测(新教材新高考)浙江省北斗星盟2021-2022学年高二上学期12月阶段性联考化学试题湖北省部分省级示范高中2021-2022学年高二上学期期末测试化学试题湖南省临澧县第一中学2021-2022学年普通高等学校全国招生考试模拟试卷(一)化学试题四川省凉山州宁南中学2021-2022学年高二下学期第二次月考化学试题四川省凉山州宁南中学2021-2022学年高二下学期开学考试化学试题(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)辽宁省沈阳市部分学校2022-2023 学年高二上学期联合体期中检测化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)T15-溶液中的离子平衡3.4.2沉淀溶解平衡原理的应用 课后广东省广州天省实验学校2022-2023学年高二上学期期末考试化学试题福建省三明第一中学2023-2024学年高二上学期12月月考化学试题河南省驻马店市确山县第一高级中学2023~2024学年高二上学期第二次月考化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
8. 肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
【实验一】 制备NaClO溶液(实验装置如图所示
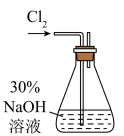
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____ (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________ 。
【实验二】 制取水合肼。(实验装置如图所示)
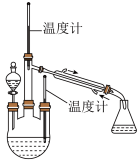
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________ (填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________ 。蒸馏时需要减压,原因是______________ 。
【实验三】 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________ ,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________ 滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________ 。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______ 。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
【实验一】 制备NaClO溶液(实验装置如图所示

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是
【实验二】 制取水合肼。(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是
【实验三】 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为
【知识点】 酸碱中和滴定原理的应用解读 物质含量的测定 中和滴定解读
您最近一年使用:0次
2020-02-24更新
|
599次组卷
|
5卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
解答题-原理综合题
|
较难(0.4)
名校
解题方法
9. 苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下:  (g)
(g)
 (g)+H2(g) △H=+17.6kJ/mol。
(g)+H2(g) △H=+17.6kJ/mol。
(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有___________ 。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________ 。
平衡常数Kp=_______ kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的
______ 。
(3)CO2气氛下乙苯催化脱氢可同时存在图1两种途径:

①b=_______ kJ/mol。
②途径I的反应历程图所示,下列说法正确的是______________ 。

a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有( )
)
d.该催化剂可提高乙苯的平衡转化率
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因____________________ 。

 (g)
(g)
 (g)+H2(g) △H=+17.6kJ/mol。
(g)+H2(g) △H=+17.6kJ/mol。(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实
平衡常数Kp=
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的

(3)CO2气氛下乙苯催化脱氢可同时存在图1两种途径:

①b=
②途径I的反应历程图所示,下列说法正确的是

a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有(
 )
) d.该催化剂可提高乙苯的平衡转化率
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因

【知识点】 化学平衡的移动及其影响因素 化学平衡常数的有关计算解读
您最近一年使用:0次
2020-02-24更新
|
342次组卷
|
2卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
解答题-工业流程题
|
适中(0.65)
名校
10. NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也用于生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等),从矿渣[含NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为___________ [Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ___________ 。在 ___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 。
。___________ ,离子交换膜(b)为 ___________ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为___________ 。
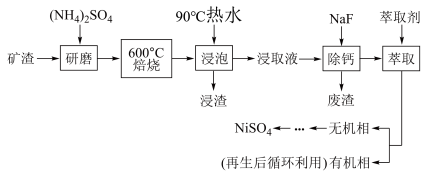
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 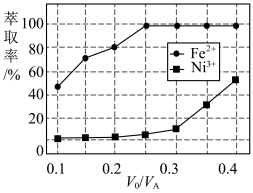
 。
。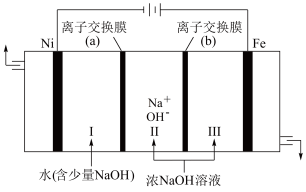
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为
您最近一年使用:0次
2023-10-03更新
|
554次组卷
|
7卷引用:【市级联考】山东省威海市2019届高三下学期5月高考模拟考试理科综合化学试题
三、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
11. 大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______ 种,基态锰原子的外围电子排布式为___ ,该原子能量最高的电子的电子云轮廓图形状为________ 。
(2)N、C和Mn电负性由大到小的顺序为____________ 。
(3)HSCH2CH2NH2中C的杂化方式为_____ ,其中NH2-空间构型为____ ;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______ 。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____ 晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
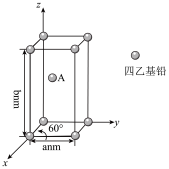
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___ ,A分子的坐标参数为_____ ;设阿伏加 德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____ g/cm3 (列出计算式即可)。
(1)碳原子核外电子的空间运动状态有
(2)N、C和Mn电负性由大到小的顺序为
(3)HSCH2CH2NH2中C的杂化方式为
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于

Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是
您最近一年使用:0次
2020-02-24更新
|
654次组卷
|
3卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题(已下线)专题6.4 物质结构与性质(选考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升北京专家2020届高三高考模拟试卷(二)化学试题
四、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为
请回答下列问题:
(1)A的名称是__________ ;B中所含官能团的名称是__________ 。
(2)反应⑤的化学方程式为__________________ ,该反应的反应类型是______________ 。
(3)G的分子式为________________ ,乙酸酐共面的原子最多有_________ 个。
(4)写出同时满足下列条件的E的同分异构体的结构简式:________________ 。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ. 该物质与足量
该物质与足量 溶液反应生成
溶液反应生成
(5)根据已有知识并结合相关信息,写出以 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
的合成路线流程图(无机试剂任选),合成路线流程图示例如下:

__________________________

已知:乙酸酐的结构简式为

请回答下列问题:
(1)A的名称是
(2)反应⑤的化学方程式为
(3)G的分子式为
(4)写出同时满足下列条件的E的同分异构体的结构简式:
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.
 该物质与足量
该物质与足量 溶液反应生成
溶液反应生成
(5)根据已有知识并结合相关信息,写出以
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
您最近一年使用:0次
2020-05-28更新
|
160次组卷
|
2卷引用:北京专家2020届高三高考模拟试卷(二)化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、物质结构与性质、有机化学基础、常见无机物及其应用、化学实验基础、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 化学在工业中的应用 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 | |
| 3 | 0.65 | 元素周期律、元素周期表的推断 根据物质性质进行元素种类推断 | |
| 4 | 0.65 | 杂化轨道理论与有机化合物空间构型 简单有机物同分异构体书写及辨识 有机分子中原子共面的判断 | |
| 5 | 0.65 | 氧化性、还原性强弱的比较 二氧化硫与其他强氧化剂的反应 Fe2+的还原性 | |
| 6 | 0.65 | 同周期元素性质递变规律 同主族元素性质递变规律 物质性质的探究 物质性质实验方案的设计 | |
| 7 | 0.65 | 溶度积规则及其应用 溶度积常数相关计算 | |
| 二、解答题 | |||
| 8 | 0.65 | 酸碱中和滴定原理的应用 物质含量的测定 中和滴定 | 实验探究题 |
| 9 | 0.4 | 化学平衡的移动及其影响因素 化学平衡常数的有关计算 | 原理综合题 |
| 10 | 0.65 | 氧化还原反应方程式的书写与配平 溶度积常数相关计算 原电池、电解池综合考查 物质分离、提纯综合应用 | 工业流程题 |
| 12 | 0.65 | 根据要求书写同分异构体 逆合成分析法 根据题给物质选择合适合成路线 有机合成综合考查 | 有机推断题 |
| 三、填空题 | |||
| 11 | 0.65 | 核外电子运动特征 基态原子的电子排布的特殊性 杂化轨道理论理解 晶胞的有关计算 | |



