黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
黑龙江
高三
一模
2017-06-05
292次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、物质结构与性质、认识化学科学
黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
黑龙江
高三
一模
2017-06-05
292次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、物质结构与性质、认识化学科学
一、多选题 添加题型下试题
多选题
|
较易(0.85)
1. 化学与生活息息相关,下列说法正确的是
| A.食盐可作调味剂,也可以用作食品防腐剂 |
| B.碳酸钾有一定的去污能力,在热水中去污能力会减弱 |
| C.煤经过气化和液化等变化后,可以减少PM2.5引起的污染 |
| D.根据纤维燃烧产生的气味,不能确定是否为蛋白质纤维 |
您最近一年使用:0次
二、单选题 添加题型下试题
单选题
|
适中(0.65)
2. 下列有机反应中属于加成反应的是
| A.苯和液溴在FeBr3催化作用下反应生成溴苯 |
| B.乙烯使酸性高锰酸钾溶液褪色 |
| C.乙烯与HCl气体反应生成一氯乙烷 |
| D.丙烯和氯气在一定条件下反应生成ClCH2CH =CH2 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
3. 某有机物分子中含有羟基,不考虑羟基与氯原子连在同一个碳原子上的情况,分子式为 C4H9ClO的有机物的同分异构体共有
| A.8种 | B.9种 | C.10种 | D.12种 |
【知识点】 同分异构体的数目的确定解读
您最近一年使用:0次
2017-06-02更新
|
456次组卷
|
7卷引用:黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
单选题
|
适中(0.65)
4. 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属:S>C |
| B | 向雨水中加入少量硫酸铁 | 容器底部出现不溶物 | 铁盐具有杀菌作用 |
| C | 向蔗糖中加入浓H2SO4 | 蔗糖变黑,并放出有刺激性气味的气体 | 浓H2SO4 具有脱水性 |
| D | 有色布条放入盛满干燥的Cl2的集气瓶中,盖上玻璃片 | 布条不褪色 | 干燥的Cl2不能漂白 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族, B、C、D.E同周期,B的核外电子数为C的1/2,D的最外层电子数为C、E之和的一半。 下列说法正确的是
| A.A、B能形成离子化合物,且A离子半径小于B离子半径 |
| B.A、D能形成离子化合物DA5,与水反应可产生两种气体 |
| C.C、D的简单氢化物中只有D溶于水,其水溶液呈酸性 |
| D.E形成的两种氢化物中所有化学键种类完全相同 |
您最近一年使用:0次
2017-06-02更新
|
189次组卷
|
2卷引用:黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
单选题
|
较难(0.4)
名校
6. 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2=NaBO2 +6H2O,有关的说法不正确的是
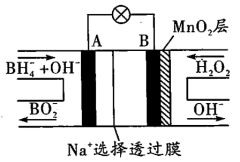

| A.纳米MnO2层的作用是提高原电池的工作效率 |
| B.放电过程中,Na+从B极区移向A极区 |
C.电池负极的电极反应为: +8OH- - 8e一= +8OH- - 8e一=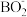 +6H2O +6H2O |
| D.在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
【知识点】 原电池电极反应式书写解读 燃料电池 原电池有关计算解读
您最近一年使用:0次
2017-06-02更新
|
696次组卷
|
3卷引用:黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
单选题
|
较难(0.4)
名校
7. 下列说法正确的是
| A.常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l |
| B.常温下pH =2的盐酸和pH =12的氨水等体积混合后c(Cl-)+c(H+)=c(NH4+)+c(OH-) |
| C.常温下0.1 mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol·L-l |
D.常温下向10 mL0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,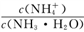 将减小 将减小 |
您最近一年使用:0次
2017-06-02更新
|
502次组卷
|
3卷引用:黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
三、填空题 添加题型下试题
填空题
|
适中(0.65)
8. 硫酸亚铁是利用钛铁矿(主要成分FeTiO3)制金属钛的副产品,价格低。以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:
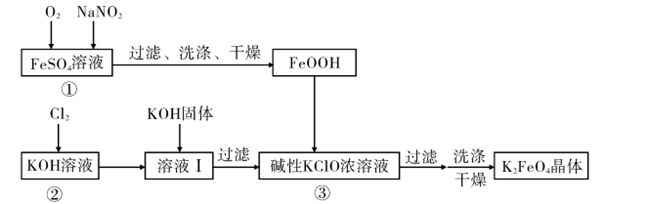
已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)写出反应①生成铁黄(FeOOH)的离子方程式:__________________________________ ,
在通入O2“氧化”FeSO4的过程中,溶液的pH________ (填“增大”“减小”或“不变”)
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是_____ 。
(3)写出反应③的化学方程式:____ 。
(4)在溶液I中加KOH固体的目的是_____ 。
(5) K2FeO4可作为新型多功能水处理剂的原因是____ 。
(6)该工艺每消耗标准状况下ll2LCl2理论上得到____ g K2FeO4。
(7)钛铁矿加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后铁的化合价不变,化学方程式为____ 。

已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)写出反应①生成铁黄(FeOOH)的离子方程式:
在通入O2“氧化”FeSO4的过程中,溶液的pH
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是
(3)写出反应③的化学方程式:
(4)在溶液I中加KOH固体的目的是
(5) K2FeO4可作为新型多功能水处理剂的原因是
(6)该工艺每消耗标准状况下ll2LCl2理论上得到
(7)钛铁矿加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后铁的化合价不变,化学方程式为
您最近一年使用:0次
填空题
|
适中(0.65)
解题方法
9. 工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:
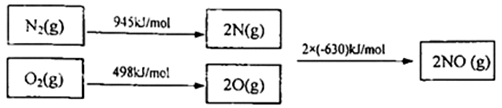
则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________ 。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g) N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
①0~2 s 内用N2表示的化学反应速率为______ 该温度下,反应的平衡常数K1________ 。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___ K2 (填“>”、“<”或“=”),原因是____________________ 。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
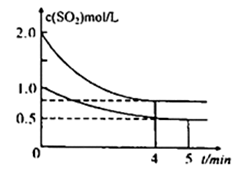
下列说法正确的是_________ (填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。
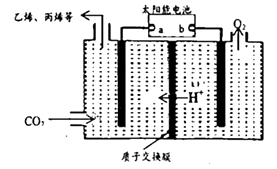
①该工艺中能量转化方式主要有___________________ 。
②电解时,生成乙烯的电极反应式是__________________________ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)
 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
下列说法正确的是
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有
②电解时,生成乙烯的电极反应式是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
2017-06-02更新
|
919次组卷
|
4卷引用:黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
10. 二价铬不稳定,极易被氧化。醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O,是一种深红色晶体,微溶于乙醇,不溶于冷水和乙醚。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
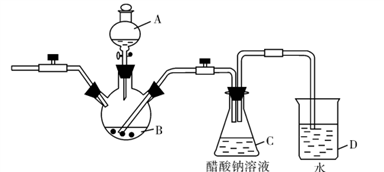
请回答下列问题:
(1)仪器A的名称是______ ,所盛装的试剂是_______ 。
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是___________ 。
(3)写出C容器中制备醋酸亚铬水合物的离子方程式_______ 。
(4)仪器D的主要作用是_______ 。
(5)指出该装置的不足之处_______ 。
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为_____ 。
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是____ (填序号)。
a.无水乙醇 b.冷的蒸馏水 c.乙醚

请回答下列问题:
(1)仪器A的名称是
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是
(3)写出C容器中制备醋酸亚铬水合物的离子方程式
(4)仪器D的主要作用是
(5)指出该装置的不足之处
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是
a.无水乙醇 b.冷的蒸馏水 c.乙醚
您最近一年使用:0次
2017-06-02更新
|
235次组卷
|
2卷引用:黑龙江省虎林市2017届高三摸底考试(最后冲刺)理综-化学试题
五、填空题 添加题型下试题
填空题
|
适中(0.65)
11. 物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____ (填元素符号),写出Fe2+的最外层电子排布式____ 。
(2)根据等电子原理,写出CN-的电子式___ ,CNO-中心原子的杂化方式为 ________ 。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是___ (用化学式表示),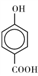 的沸点比
的沸点比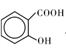
____ (填“高”或“低”);原因是______________________ .
(4)铁有δ、γ、α三种同素异形体,如下图所示。
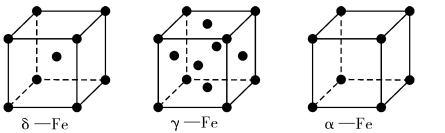
γ -Fe晶体的一个晶胞中所含有的铁原子数为____ ,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____ 。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____ pm(列表达式)。
(1)C、H、N、O四种元素中电负性最大的是
(2)根据等电子原理,写出CN-的电子式
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是
 的沸点比
的沸点比
(4)铁有δ、γ、α三种同素异形体,如下图所示。

γ -Fe晶体的一个晶胞中所含有的铁原子数为
您最近一年使用:0次
六、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
12. 异戊酸薄荷酯(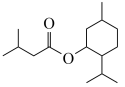 )是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
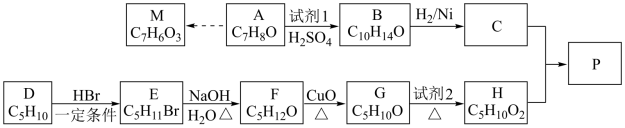
已知: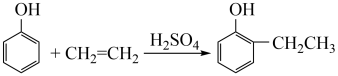 ;
;
 (R表示烷基)
(R表示烷基)
完成下列问题:
(1)A的化学名称为____ 。试剂1的结构简式为____ 。
(2)由E生成F的化学方程式为____ 。
(3)试剂2可以是____ 试剂(填名称或化学式);该反应类型是 ____ 。
(4)由C和H生成P的化学方程式为____ 。
(5)M有多种同分异构体,写出所有满足下列条件的同分异构体的结构简式:____ 。
①属于酚类 ②能发生银镜反应
③核磁共振氢谱有4种峰、且峰值比为1:2:2:1
(6)苯乙烯是一种重要的化工原料。参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:___ 。
(合成路线常用的表示方法为: )
)
 )是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
已知:
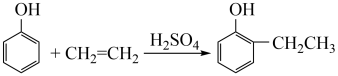 ;
; (R表示烷基)
(R表示烷基) 完成下列问题:
(1)A的化学名称为
(2)由E生成F的化学方程式为
(3)试剂2可以是
(4)由C和H生成P的化学方程式为
(5)M有多种同分异构体,写出所有满足下列条件的同分异构体的结构简式:
①属于酚类 ②能发生银镜反应
③核磁共振氢谱有4种峰、且峰值比为1:2:2:1
(6)苯乙烯是一种重要的化工原料。参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:
(合成路线常用的表示方法为:
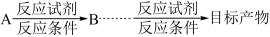 )
)
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、物质结构与性质、认识化学科学
试卷题型(共 12题)
题型
数量
多选题
1
单选题
6
填空题
3
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、多选题 | |||
| 1 | 0.85 | 盐类水解的应用 利用灼烧进行蛋白质的鉴别 煤的气化 煤的液化 化学在农业中的应用 化学在工业中的应用 | |
| 二、单选题 | |||
| 2 | 0.65 | 加成反应 | |
| 3 | 0.65 | 同分异构体的数目的确定 | |
| 4 | 0.65 | 次氯酸及其性质 浓硫酸的脱水性 溶液的酸碱性与pH的关系 化学实验方案的设计与评价 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 元素周期律的应用 根据原子结构进行元素种类推断 化学键基本概念 | |
| 6 | 0.4 | 原电池电极反应式书写 燃料电池 原电池有关计算 | |
| 7 | 0.4 | 水的电离 溶液的酸碱性与pH 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 三、填空题 | |||
| 8 | 0.65 | 氧化还原反应的应用 高铁酸钠 常见无机物的制备 | |
| 9 | 0.65 | 化学反应原理综合考查 盖斯定律与热化学方程式 化学平衡的有关计算 电解原理 | |
| 11 | 0.65 | 物质结构与性质综合考查 电子排布式 元素性质与电负性的关系 等电子原理的应用 氢键对物质性质的影响 根据晶胞结构确定晶体化学式 晶胞的有关计算 晶格能 | |
| 四、解答题 | |||
| 10 | 0.65 | 物质的分离、提纯 化学实验基础操作 常见无机物的制备 | 实验探究题 |
| 12 | 0.65 | 有机物的推断 逆合成分析法 根据题给物质选择合适合成路线 有机合成综合考查 | 有机推断题 |



