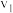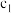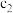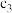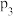恒压下,将CO2和H2以体积比1∶4混合进行反应CO2(g)+4H2(g) CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
 CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
| A.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH>0 |
| B.图中450 ℃时,延长反应时间无法提高CO2的转化率 |
| C.350 ℃时,c(H2)起始=0.4 mol·L-1,CO2平衡转化率为80%,则平衡常数K<2 500 |
| D.当温度从400 ℃升高至500 ℃,反应处于平衡状态时,v(400℃)逆>v(500℃)逆 |
2020·江苏·二模 查看更多[6]
江苏省苏锡常镇四市2020届高三第二次模拟考试(5月) 化学试题河北省石家庄市第二中学本部2019-2020学年高一下学期期末结业考试化学试题重庆市缙云教育联盟2020-2021学年高二9月月考化学试题辽宁省新高考2021届高三上学期第二次调研化学试题河南省郑州励德双语学校2020-2021学年高二上学期期中考试化学试题(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)
更新时间:2020-06-01 16:39:27
|
相似题推荐
多选题
|
较难
(0.4)
名校
【推荐1】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应: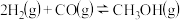 ,达到平衡,下列说法不正确的是。
,达到平衡,下列说法不正确的是。
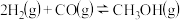 ,达到平衡,下列说法不正确的是。
,达到平衡,下列说法不正确的是。| 容器 | 温度/K | 物质的起始浓度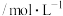 | 物质的平衡浓度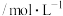 | ||
 | 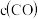 | 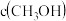 | 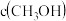 | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A.该反应的正反应为放热反应 |
| B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 |
C.达到平衡时,容器Ⅱ中 大于容器Ⅲ中 大于容器Ⅲ中 的两倍 的两倍 |
| D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应3H2(g)+N2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1,测得反应的相关数据如下:
下列说法正确的是( )
| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 500 | 500 | 300 |
| 反应物投入量 | 3 mol H2、1 mol N2 | 4 mol NH3 | 2 mol NH3 |
| 平衡v正(N2)/mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(NH3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 达到平衡时能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 达到平衡时体积分数 | φ1(NH3) | φ2(NH3) | φ3(NH3) |
| 物质的平衡转化率α | α1(H2) | α2(NH3) | α3(NH3) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,c2>2c1 | B.K1=K2,p2>2p1 |
| C.φ1(NH3)<φ3(NH3),a+0.5b<92.4 | D.c2>2c3,α1(H2)+α3(NH3)>1 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】利用传感技术可以探究压强对2NO2(g) N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
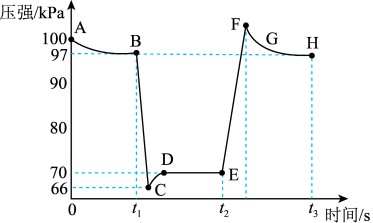
 N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
| A.B点处NO2的转化率为3% |
| B.E点到H点的过程中,NO2的物质的量先增大后减小 |
| C.E、H两点对应的正反应速率:vH>vE |
| D.B、E两点气体的平均相对分子质量:MB>ME |
您最近一年使用:0次
【推荐2】一定条件下,分别向体积为1L的密闭容器中充入气体,发生反应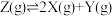 ,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
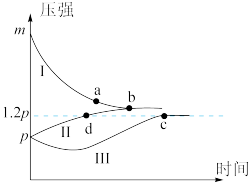
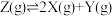 ,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
| 实验 | 充入气体量 | 反应过程条件 |
| ① | 2mol X+1mol Y | 恒温 |
| ② | 1molZ | 恒温 |
| ③ | 1molZ | 绝热 |
A.曲线Ⅰ对应实验①,且 | B.Z的转化率:b<c |
C.气体的总物质的量: | D.b点平衡常数: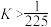 |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】体积均为2L的多个恒容密闭容器,分别充入1mol CO(g)和1mol  (g)发生反应
(g)发生反应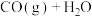

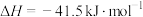 ,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数
,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数 (
( 或
或 )、
)、 体积分数与热力学温度的倒数关系如图所示,下列说法错误的是
体积分数与热力学温度的倒数关系如图所示,下列说法错误的是
 (g)发生反应
(g)发生反应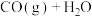

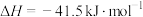 ,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数
,在不同温度下反应50s,测得正、逆反应的平衡常数的自然对数 (
( 或
或 )、
)、 体积分数与热力学温度的倒数关系如图所示,下列说法错误的是
体积分数与热力学温度的倒数关系如图所示,下列说法错误的是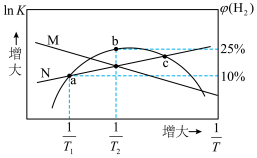
A.曲线N表示 的变化情况 的变化情况 |
B.0~50s,a点对应容器中的反应的平均速率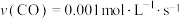 |
| C.b点时一定处于平衡状态 |
D.c点时,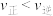 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐2】100℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:X(g)+2Y(g)  Z(g)反应过程中测定的部分数据见下表:
Z(g)反应过程中测定的部分数据见下表:
下列说法正确的是
 Z(g)反应过程中测定的部分数据见下表:
Z(g)反应过程中测定的部分数据见下表:反应时间/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
| A.前10 min内反应的平均速率为v(Z)=0.10 mol·L-1·min-1 |
| B.温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 |
| C.若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L |
| D.保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐3】在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是

 CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是
| A.该反应的正反应为吸热反应 |
| B.三个容器容积:①>②>③ |
| C.在P点,CO转化率为75% |
| D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时v(CO)正>v(CO)逆 |
您最近一年使用:0次
【推荐1】在3个体积均为2.0L的恒容密闭容器中,反应H2O(g)+C(s) CO(g)+H2(g)△H>0分别在一定温度下达到化学平衡状态。下列说法正确的是
CO(g)+H2(g)△H>0分别在一定温度下达到化学平衡状态。下列说法正确的是
 CO(g)+H2(g)△H>0分别在一定温度下达到化学平衡状态。下列说法正确的是
CO(g)+H2(g)△H>0分别在一定温度下达到化学平衡状态。下列说法正确的是容器 | 温度(T1>T2) | 起始时物质的量/mol | 平衡时物质的量/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.6 | 1.2 | 0 | 0 | 0.2 |
II | T1 | 1.2 | 1.2 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.6 | 0.6 | y |
| A.当温度为T1时,该反应的化学平衡常数值为0.05 |
| B.若5min后容器I中达到平衡,则5min内的平均反应速率:v(H2)=0.04mol·L-1·min-1 |
| C.达到平衡时,容器II中H2O的转化率比容器I中的小 |
| D.达到平衡时,容器III中的CO的转化率小于66.6% |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐2】25℃时,将含有I-的溶液逐滴加入到含有Hg2+的溶液中,发生一系列可逆反应生成HgI+、HgI2(s)、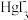 、
、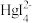 。其中,Hg2+、HgI+、
。其中,Hg2+、HgI+、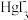 、
、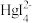 四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
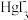 、
、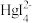 。其中,Hg2+、HgI+、
。其中,Hg2+、HgI+、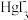 、
、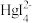 四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是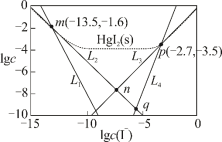
| A.Ksp(HgI2)的数量级为10-28 |
| B.n点的坐标为(-7.15,-7.95) |
C.反应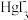 (aq) (aq) HgI2(s)+I-(aq)的平衡常数为K=10-0.8 HgI2(s)+I-(aq)的平衡常数为K=10-0.8 |
D.q点溶液中存在:c(H+)+2c(Hg2+)=c(OH-)+c(I-)+c(HgI )+c(HgI )+c(HgI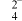 ) ) |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐3】二甲醚是一种重要的化工原料,研究发现 催化加氢合成二甲醚。过程中发生反应为:
催化加氢合成二甲醚。过程中发生反应为:
①

②
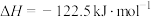
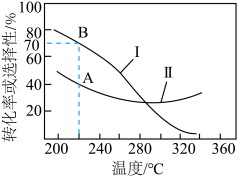
恒温恒压条件下,向密闭容器中加入物质的量之比为 的
的 和
和 混合气体,平衡时
混合气体,平衡时 或CO的选择性及
或CO的选择性及 平衡转化率随温度的变化如图所示,下列说法正确的是
平衡转化率随温度的变化如图所示,下列说法正确的是
已知: 的选择性
的选择性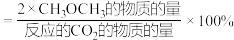
 催化加氢合成二甲醚。过程中发生反应为:
催化加氢合成二甲醚。过程中发生反应为:①


②

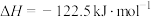
恒温恒压条件下,向密闭容器中加入物质的量之比为
 的
的 和
和 混合气体,平衡时
混合气体,平衡时 或CO的选择性及
或CO的选择性及 平衡转化率随温度的变化如图所示,下列说法正确的是
平衡转化率随温度的变化如图所示,下列说法正确的是已知:
 的选择性
的选择性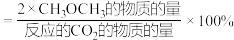

| A.图中曲线I表示平衡时CO的选择性随温度的变化 |
| B.温度高于300℃,温度对反应①正向移动的影响程度小于对反应②的逆向移动的影响程度 |
C.增大压强、使用对反应②催化活性更高的催化剂一定能提高 选择性 选择性 |
| D.温度220℃时,反应①的平衡常数约为0.053 |
您最近一年使用:0次

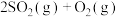
 正反应放热
正反应放热 ,测得反应的相关数据如下:
,测得反应的相关数据如下:




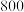
 、
、