在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。测得平衡时CH4的体积分数与温度及压强的关系如图1所示。回答下列问题:
2CO(g)+2H2(g)。测得平衡时CH4的体积分数与温度及压强的关系如图1所示。回答下列问题:

(1)该反应的ΔH__ 0。(填“<”“>”或“=”)
(2)压强p1、p2、p3由大到小的顺序为__ ;压强为p2时,b点处v正__ v逆;(填“<”“>”或“=”)
(3)a点时CH4的转化率为___ 。
(4)为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO),如图2。
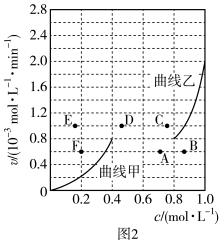
①与曲线v正~c(CH4)相对应的是图中曲线__ (填“甲”或“乙”)。
②降低温度,反应重新达到平衡时,v正、v逆相应的平衡点分别为__ (填字母)。
 2CO(g)+2H2(g)。测得平衡时CH4的体积分数与温度及压强的关系如图1所示。回答下列问题:
2CO(g)+2H2(g)。测得平衡时CH4的体积分数与温度及压强的关系如图1所示。回答下列问题:
(1)该反应的ΔH
(2)压强p1、p2、p3由大到小的顺序为
(3)a点时CH4的转化率为
(4)为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO),如图2。

①与曲线v正~c(CH4)相对应的是图中曲线
②降低温度,反应重新达到平衡时,v正、v逆相应的平衡点分别为
更新时间:2020-08-19 10:59:26
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和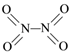 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____ mol·(L·s)-1。
②n3____ n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________ ,升高温度后,反应2NO2 N2O4的平衡常数K将
N2O4的平衡常数K将_______ (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________ mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________ 。(结果保留小数点后一位)
 和
和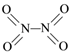 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。(1)写出N2O4转化为NO2的热化学方程式
(2)对反应N2O4(g)
 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3
 N2O4的平衡常数K将
N2O4的平衡常数K将③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是
④计算③中条件下达到平衡后混合气体的平均相对分子质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.完成下列问题
(1)列事实或做法与化学反应速率无关的是___________
(2)下列事实能用勒夏特列原理解释的是_______
(3)反应3A(g) 2B(g)+C(g)(ΔH<0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变。下列判断正确的是_______
2B(g)+C(g)(ΔH<0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变。下列判断正确的是_______

Ⅱ.氮氧化物(NOx)的任意排放会造成酸雨、光化学烟雾等环境污染问题,其与悬浮在大气中的海盐粒子相互作用时,发生反应:4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)。
2NaNO3(s)+2NO(g)+Cl2(g)。
(4)该反应的平衡常数表达式K=___________
(5)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是___________ (选填编号)。
a.v(NO2)=2v(NO) b.NO2和NO的物质的量之和保持不变
c.混合气体密度保持不变 d.c(NO2)∶c(NO)∶c(Cl2)=4∶2∶1
Ⅲ.上述反应可以视作分两步进行:
(ⅰ)……
(ⅱ)2ClNO(g) 2NO(g)+Cl2(g);ΔH>0
2NO(g)+Cl2(g);ΔH>0
(6)反应ⅰ的化学方程式可能是___________ ;反应ⅱ中反应物化学键总能量___________ 生成物化学键总能量(填“高于”“低于”或“等于”)。
(7)保持恒温条件,将2molClNO充入不同容积的密闭容器中进行反应ⅱ,充分反应达到平衡后,反应物的转化率与容器容积及不同温度的关系如图所示:

①图中T1、T2的关系为T1___________ T2(填“>”“<”或“=”);A、B、C各自对应化学平衡常数大小关系是___________ 。
②若从起始到处于A点状态共经过10min,该时间段内化学反应速率v(NO)=___________ 。
Ⅳ.工业中利用新型催化剂M催化氨气与NO反应生成N2,从而去除NO的影响:4NH3(g)+6NO(g) 5N2(g)+6H2O(g);ΔH=-2070kJ·mol-1,相同时间内,NO的去除率随反应温度的变化曲线如图所示。
5N2(g)+6H2O(g);ΔH=-2070kJ·mol-1,相同时间内,NO的去除率随反应温度的变化曲线如图所示。
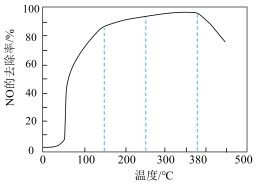
(8)在50~150℃范围内随着温度的升高,NO的去除率上升的原因可能是(任写一点):_________ 。
(1)列事实或做法与化学反应速率无关的是___________
| A.将食物存放在温度低的地方 | B.用铁作催化剂合成氨 |
| C.将煤块粉碎后燃烧 | D.用浓硝酸和铜反应制备NO2气体 |
(2)下列事实能用勒夏特列原理解释的是_______
| A.NO2气体受压缩后,颜色先变深后变浅 |
B.对2HI(g) H2(g)+I2(g)平衡体系加压,颜色迅速变深 H2(g)+I2(g)平衡体系加压,颜色迅速变深 |
| C.接触法制硫酸中,采用500℃高温条件下制备SO3 |
| D.配制硫酸亚铁溶液时,常加入少量铁屑防止氧化 |
(3)反应3A(g)
 2B(g)+C(g)(ΔH<0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变。下列判断正确的是_______
2B(g)+C(g)(ΔH<0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变。下列判断正确的是_______
| A.t6~t7阶段,C的百分含量最大 | B.t2~t3阶段,A的转化率最小 |
| C.t3时,改变因素一定是使用了催化剂 | D.t5时,改变因素一定是升高了温度 |
Ⅱ.氮氧化物(NOx)的任意排放会造成酸雨、光化学烟雾等环境污染问题,其与悬浮在大气中的海盐粒子相互作用时,发生反应:4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)。
2NaNO3(s)+2NO(g)+Cl2(g)。(4)该反应的平衡常数表达式K=
(5)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是
a.v(NO2)=2v(NO) b.NO2和NO的物质的量之和保持不变
c.混合气体密度保持不变 d.c(NO2)∶c(NO)∶c(Cl2)=4∶2∶1
Ⅲ.上述反应可以视作分两步进行:
(ⅰ)……
(ⅱ)2ClNO(g)
 2NO(g)+Cl2(g);ΔH>0
2NO(g)+Cl2(g);ΔH>0(6)反应ⅰ的化学方程式可能是
(7)保持恒温条件,将2molClNO充入不同容积的密闭容器中进行反应ⅱ,充分反应达到平衡后,反应物的转化率与容器容积及不同温度的关系如图所示:

①图中T1、T2的关系为T1
②若从起始到处于A点状态共经过10min,该时间段内化学反应速率v(NO)=
Ⅳ.工业中利用新型催化剂M催化氨气与NO反应生成N2,从而去除NO的影响:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g);ΔH=-2070kJ·mol-1,相同时间内,NO的去除率随反应温度的变化曲线如图所示。
5N2(g)+6H2O(g);ΔH=-2070kJ·mol-1,相同时间内,NO的去除率随反应温度的变化曲线如图所示。
(8)在50~150℃范围内随着温度的升高,NO的去除率上升的原因可能是(任写一点):
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】短链烯烃是重要的有机化工原料,如丙烯(C3H6)和乙烯等。利用它们间的转化可有效强化节能减排,达到“碳达峰”和“碳中和”的目的。请回答下列问题:
(1)丙烯可由丙烷脱氢制取。
已知:反应I. 2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1 =-238 kJ•mol-1
2C3H6(g)+2H2O(g) ΔH1 =-238 kJ•mol-1
反应II. 2H2(g)+O2(g) 2H2O(g) ΔH2 =-484 kJ•mol-1
2H2O(g) ΔH2 =-484 kJ•mol-1
则 C3H8(g) C3H6(g)+H2(g) ΔH=
C3H6(g)+H2(g) ΔH=___________ kJ/mol。
(2)乙烯可由CO2和H2制取。
反应为2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2 mol CO2(g)和6 mol H2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2 mol CO2(g)和6 mol H2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
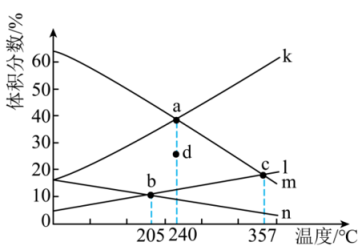
①下列说法正确的是___________ 。
A.b点时:2v正(H2)=3v逆(H2O)
B.将H2O(g)液化分离可提高C2H4的产率
C.活性更高的催化剂可提高CO2的平衡转化率
D.a、b、c三点的平衡常数:Ka>Kc>Kb
②表示CO2体积分数随温度变化的曲线是___________ (填“k”“l”“m”或“n”)
③若d点表示240 ℃某时刻H2的体积分数,保持温度不变,则反应向___________ (填“正”或“逆”)反应方向进行。
④205℃,反应达b点所用时间为t min,则此过程中用C2H4表示的反应速率是___________ mol/min。若平衡时b点总压为P,则平衡常数Kp=___________ (列出计算式,以分压表示,分压=总压×物质的量分数)。
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如图所示。使用催化剂X,当温度高于320 ℃,CO2转化随着温度升高而下降的原因是___________ 。

(1)丙烯可由丙烷脱氢制取。
已知:反应I. 2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) ΔH1 =-238 kJ•mol-1
2C3H6(g)+2H2O(g) ΔH1 =-238 kJ•mol-1反应II. 2H2(g)+O2(g)
 2H2O(g) ΔH2 =-484 kJ•mol-1
2H2O(g) ΔH2 =-484 kJ•mol-1则 C3H8(g)
 C3H6(g)+H2(g) ΔH=
C3H6(g)+H2(g) ΔH=(2)乙烯可由CO2和H2制取。
反应为2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2 mol CO2(g)和6 mol H2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2 mol CO2(g)和6 mol H2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
①下列说法正确的是
A.b点时:2v正(H2)=3v逆(H2O)
B.将H2O(g)液化分离可提高C2H4的产率
C.活性更高的催化剂可提高CO2的平衡转化率
D.a、b、c三点的平衡常数:Ka>Kc>Kb
②表示CO2体积分数随温度变化的曲线是
③若d点表示240 ℃某时刻H2的体积分数,保持温度不变,则反应向
④205℃,反应达b点所用时间为t min,则此过程中用C2H4表示的反应速率是
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如图所示。使用催化剂X,当温度高于320 ℃,CO2转化随着温度升高而下降的原因是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)已知:①4NH3(g)+3O2(g)⇌2N2(g)+6H2O(l) △H1=﹣a kJ•mol﹣1
②H2(g)+ O2(g)═H2O(1) △H2=﹣b kJ•mol﹣1
O2(g)═H2O(1) △H2=﹣b kJ•mol﹣1
NH3分解的热化学方程式为___________ 。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) △H。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=﹣lgK,K表示反应平衡常数)随温度T的变化如图2所示。
①由图1请判断该反应△H___________ 0(请填入“>”、“<”或“=”)。在T1~T2温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___________ 。

②图1中点1、2对应的反应速率v1(逆)___________ v2(正)(填“>”、“=”或“<”)。
③图2中特定温度下pK的值对应C点,则随温度变化A、B、D、E四点中变化趋势合理的是___________ 。
④乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)⇌CH3OCH3(g) △H=+50.7 kJ•mol﹣1,该反应的速率方程可表示为v(正)=k(正)•c(C2H5OH)和v逆=k逆•c(CH3OCH3),k(正)和k(逆)只与温度有关。该反应的活化能Ea(正)___________ (填“>”、“=”或“<”)Ea(逆),已知:T℃时,k(正)=0.006 s﹣1,k(逆)=0.002 s﹣1,该温度下向某恒容密闭容器中充入1.5 mol乙醇和4 mol甲醚,请判断此时反应的移动方向并给出理由__________
(1)已知:①4NH3(g)+3O2(g)⇌2N2(g)+6H2O(l) △H1=﹣a kJ•mol﹣1
②H2(g)+
 O2(g)═H2O(1) △H2=﹣b kJ•mol﹣1
O2(g)═H2O(1) △H2=﹣b kJ•mol﹣1NH3分解的热化学方程式为
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) △H。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=﹣lgK,K表示反应平衡常数)随温度T的变化如图2所示。
①由图1请判断该反应△H

②图1中点1、2对应的反应速率v1(逆)
③图2中特定温度下pK的值对应C点,则随温度变化A、B、D、E四点中变化趋势合理的是
④乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)⇌CH3OCH3(g) △H=+50.7 kJ•mol﹣1,该反应的速率方程可表示为v(正)=k(正)•c(C2H5OH)和v逆=k逆•c(CH3OCH3),k(正)和k(逆)只与温度有关。该反应的活化能Ea(正)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。
(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①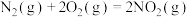 △H1
△H1
② △H2
△H2
③ △H3
△H3
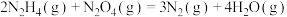 的反应热△H=
的反应热△H=______ (写出表达式)。
(2) N2H4的水溶液呈弱碱性,室温下其电离常数 ,则0.01 mol∙L-1的N2H4水溶液pH等于
,则0.01 mol∙L-1的N2H4水溶液pH等于______ (忽略N2H4的二级电离和H2O的电离,lg4=0.6)。
(3)利用测压法在刚性密闭容器中研究T1℃时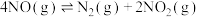 (△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
①0~20 min时,v(NO2)=______ MPa∙min-1。
②T1℃时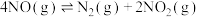 反应的平衡常数Kx=
反应的平衡常数Kx=______ (Kx为以物质的量分数表示的平衡常数)。若升高温度,N2的物质的量分数将______ (填“增大”“减小”或“不变”)。
(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应 △H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
△H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
①________________________________________________ ;
②________________________________________________ 。

(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①
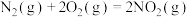 △H1
△H1②
 △H2
△H2③
 △H3
△H3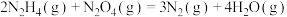 的反应热△H=
的反应热△H=(2) N2H4的水溶液呈弱碱性,室温下其电离常数
 ,则0.01 mol∙L-1的N2H4水溶液pH等于
,则0.01 mol∙L-1的N2H4水溶液pH等于(3)利用测压法在刚性密闭容器中研究T1℃时
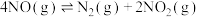 (△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
②T1℃时
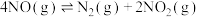 反应的平衡常数Kx=
反应的平衡常数Kx=(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应
 △H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
△H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):①
②

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】平衡移动是化学平衡研究的重要方向。
(1)在 溶液中存在平衡:
溶液中存在平衡: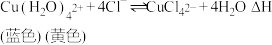
某兴趣小组取适量 固体进行下面实验:
固体进行下面实验:
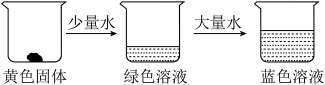
①向 固体中加入少量水时,溶液呈绿色的原因是:
固体中加入少量水时,溶液呈绿色的原因是:_______________________________________ ;
②取少量蓝色溶液加热后,溶液变为绿色,则
_____________ 0;(填“>”、“<”或“=”)
③另取少量蓝色溶液滴加几滴浓盐酸,溶液颜色变为__________________________ 。
(2)已知:a. 与
与 反应存在一定限度:
反应存在一定限度: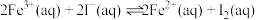 ;
;
b. 为黄色沉淀,且溶解度比
为黄色沉淀,且溶解度比 小很多。
小很多。

①ⅰ中蓝色变深,说明加入 饱和
饱和 溶液后,平衡
溶液后,平衡_____________ 移动。(填“正向”、“逆向”或“不”)
②ⅱ中蓝色变浅,用平衡移动解释其原因为__________________________ 。
③ⅲ中出现_____________ 色沉淀,静置后溶液颜色与ⅳ相比更_____________ 。(填“深”或“浅”)
(1)在
 溶液中存在平衡:
溶液中存在平衡: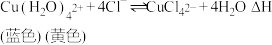
某兴趣小组取适量
 固体进行下面实验:
固体进行下面实验:
①向
 固体中加入少量水时,溶液呈绿色的原因是:
固体中加入少量水时,溶液呈绿色的原因是:②取少量蓝色溶液加热后,溶液变为绿色,则

③另取少量蓝色溶液滴加几滴浓盐酸,溶液颜色变为
(2)已知:a.
 与
与 反应存在一定限度:
反应存在一定限度: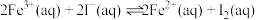 ;
;b.
 为黄色沉淀,且溶解度比
为黄色沉淀,且溶解度比 小很多。
小很多。
①ⅰ中蓝色变深,说明加入
 饱和
饱和 溶液后,平衡
溶液后,平衡②ⅱ中蓝色变浅,用平衡移动解释其原因为
③ⅲ中出现
您最近一年使用:0次
【推荐1】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________ 。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式_____________________________________ 。
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
①0~10min内,NO的平均反应速率v(NO)=___________ ,当升高反应温度,该反应的平衡常数K___________ (选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________ ;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________ (只列出计算式)(已知:气体分压=气体总压×体积分数)。
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol反应b:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
浓度(mol∙L-1) | 时间(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
(1)催化反应室中的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算ΔH=_______ 。反应来自煤的气化。已知该反应的平衡常数表达式为K=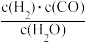 ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________ 。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________ 。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正___ v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___ 。
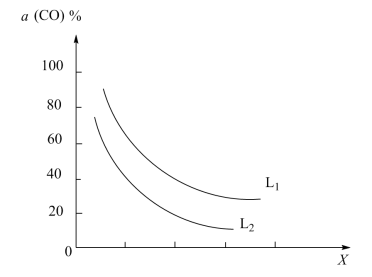
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___ (填“温度”或“压强”),且L1___ L2(填“>”“<”或“=”)。
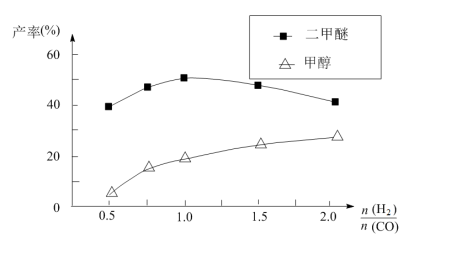
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____ 。
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
(1)催化反应室中的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算ΔH=
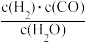 ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L−1) | 0.46 | 1.0 | 1.0 |
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表

(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比
 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:N2(g)+3H2(g)⇌2NH3(g) ∆H=-92.4kJ·mol-1 ∆S=-200J·K-1·mol-1。回答下列问题:
(1)合成氨反应在常温下_______ (填“能”或“不能”)自发。
(2)_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二: 复合催化剂。
复合催化剂。

下列说法正确的是_______ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: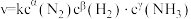 ,根据表中数据,
,根据表中数据,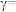
_______ ;
在合成氨过程中,需要不断分离出氨的原因为_______ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)在初始压强为20MPa、450℃、容积恒定、催化剂条件下发生合成氨反应,按物质的量比值n(N2):n(H2)=1:3充入反应物,氢气的平衡转化率为60%,则Kp=_______ (保留三位小数)。
(1)合成氨反应在常温下
(2)
 。
。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二:
 复合催化剂。
复合催化剂。
下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
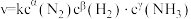 ,根据表中数据,
,根据表中数据,
| 实验 | 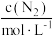 | 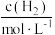 |  | 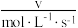 |
| 1 | m | n | p | q |
| 2 | 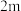 | n | p |  |
| 3 | m | n |  | 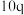 |
| 4 | m |  | p | 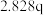 |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)在初始压强为20MPa、450℃、容积恒定、催化剂条件下发生合成氨反应,按物质的量比值n(N2):n(H2)=1:3充入反应物,氢气的平衡转化率为60%,则Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
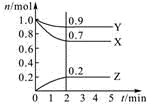
(1)该反应的化学方程式为___ 。
(2)反应开始至2min,用Y表示的平均反应速率为___ 。
(3)在密闭容器里,通入amolA(g)和bmolB(g),发生反应A(g)+B(g)=2C(g),当改变下列条件时,会加快反应速率的是__ (填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量

(1)该反应的化学方程式为
(2)反应开始至2min,用Y表示的平均反应速率为
(3)在密闭容器里,通入amolA(g)和bmolB(g),发生反应A(g)+B(g)=2C(g),当改变下列条件时,会加快反应速率的是
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
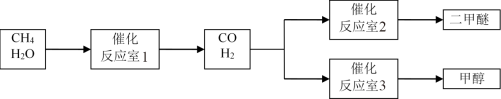
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____ 。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____ 。
(3)反应室1中发生反应:CH4(g)+H2O (g) CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______ mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______ v逆(填“>”、“<”或“=”)。
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________ 。

(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。

①该电池的正极反应式为_____ 。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________ L(标准状况)。

已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=
(3)反应室1中发生反应:CH4(g)+H2O (g)
 CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):| 反应时间/min | n(CH4)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是

(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。

①该电池的正极反应式为
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】中科院天津工业生物所利用光伏发电,将电解水获得的H2与CO2反应合成甲醇,再由甲醇经若干酶促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成。回答下列问题:
(1)该研究成果的重大意义是____ 。(答出一点即可)
(2)已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
①反应I的焓变ΔH1=____ kJ∙mol-1。
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应I和II,起始及达平衡时,容器内各气体的物质的量如表所示。
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=____ ,反应I的平衡常数Kp=____ 。(含p的式子表示)
(3)取物质的量浓度为amol∙L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
①根据表中数据选取最佳的反应条件____ 。
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是____ 。
③实验4可用淀粉的质量浓度表示反应速率为____ g∙L-1∙h-1。淀粉的产率为____ 。(用含a的式子表示)
(1)该研究成果的重大意义是
(2)已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。
| 化合物 | CO2(g) | CH3OH(g) | H2O(g) |
| 摩尔生成焓/(kJ∙mol-1) | -395 | -200 | -242 |
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2①反应I的焓变ΔH1=
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应I和II,起始及达平衡时,容器内各气体的物质的量如表所示。
| CO2 | H2 | CH3OH | CO | H2O | |
| 起始量/mol | 4.0 | 8.0 | 0 | 0 | 0 |
| 平衡量/mol | n1 | 3.0 |
(3)取物质的量浓度为amol∙L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
| 实验序号 | 温度/K | 不同工程酶的组块 | 淀粉/(g∙L-1) |
| 1 | T1 | agp-M1 | 0.21 |
| 2 | T1 | agp-M2 | 0.38 |
| 3 | T2 | agp-M2 | 1.82 |
| 4 | T2 | agp-M3 | 1.24 |
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是
③实验4可用淀粉的质量浓度表示反应速率为
您最近一年使用:0次



